
【题目】铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素. 铁、钴、镍都是很好的配位化合物形成体.
(1)[Co(H2O)6]2+在过量氨水中易转化为[Co(NH3)6]2+。H2O 和 N H3 中与 Co2+配位能力较强的是_____,[Co(H2O)6]2+中 Co2+的配位数为___;从轨道重叠方式看,NH3 分子中的化学键类型为___ , H2O 分子的立体构型为___。
(2)铁、镍易与一氧化碳作用形成羰基配合物,中心原子价电子数与配位体提供的成键电子数 遵循 18e-规则。如:Fe(CO)5,则镍与 CO 形成的配合物化学式为_________。常温下 Fe(CO)5 为 黄色油状液体,则 Fe(CO)5 固态为_____晶体。Fe(CO)5 晶体中存在的作用力有___,写出与 CO 互为等电子体的一种阴离子的离子符号_____,Fe(CO)5 中σ键和π键数目之比为______。
(3)一种铁单质其晶胞与钠、钾晶胞相同,如果该铁单质的晶胞参数为 a cm,则相距最近的两 个铁原子核间距为_____cm (用含 a 的式子表示)。
【答案】![]() 6
6 ![]()
![]() 形
形 ![]() 分子 范德华力、配位键和共价键
分子 范德华力、配位键和共价键 ![]() 1:1
1:1 ![]()
【解析】
(1)配合物向生成更稳定的配合物转化,![]() 在过量氨水中易转化为
在过量氨水中易转化为 ![]() ,所以
,所以 ![]() 和
和 ![]() 中与
中与 ![]() 配位能力较强的是
配位能力较强的是 ![]() ;
;![]() 中配体为
中配体为 ![]() ,配合物的配位数为
,配合物的配位数为 ![]() ;
;![]() 中价层电子对个数
中价层电子对个数 ![]() ,且含有
,且含有 ![]() 个孤电子对,所以
个孤电子对,所以 ![]() 原子采用
原子采用 ![]() 杂化,所以从轨道重叠方式看,
杂化,所以从轨道重叠方式看,![]() 分子中的化学键类型为
分子中的化学键类型为 ![]() 键;
键;![]() 中
中 ![]() 原子的价层电子对个数
原子的价层电子对个数 ![]() 且含有
且含有 ![]() 个孤电子对,所以
个孤电子对,所以 ![]() 原子采用
原子采用 ![]() 杂化,其空间构型为
杂化,其空间构型为 ![]() 形结构。
形结构。
(2)中心原子价电子数与配位体提供的成键电子数遵循 18 电子规则,镍中心原子价电子数为 10,则镍与 ![]() 形成的配合物化学式为
形成的配合物化学式为 ![]() ;常温下
;常温下 ![]() 为 黄色油状液体,说明该晶体熔沸点低,为分子晶体,则
为 黄色油状液体,说明该晶体熔沸点低,为分子晶体,则 ![]() 晶体中存在分子间范德华力,分子内含有配位键,配体中含有共价键,所以
晶体中存在分子间范德华力,分子内含有配位键,配体中含有共价键,所以 ![]() 晶体中存在的作用力有范德华力、配位键和共价键;
晶体中存在的作用力有范德华力、配位键和共价键;![]() 、
、![]() 的原子数都是
的原子数都是 ![]() ,价电子数都是 10,则互为等电子体;
,价电子数都是 10,则互为等电子体;![]() 中含有
中含有 ![]() 个配位键属于
个配位键属于 ![]() 键,配体
键,配体 ![]() 分子中
分子中 ![]() 原子上有一对孤对电子,
原子上有一对孤对电子,![]() 、
、![]() 原子都符合
原子都符合 ![]() 电子稳定结构,则
电子稳定结构,则 ![]() 、
、![]() 之间为三键,三键中含有
之间为三键,三键中含有 ![]() 个
个 ![]() 键、
键、![]() 个
个 ![]() 键,所以
键,所以 ![]() 中
中 ![]() 键和
键和 ![]() 键数目之比为
键数目之比为 ![]() 。
。
(3)![]() 、
、![]() 晶胞为体心结构,所以这种铁单质的晶胞为体心结构,并且
晶胞为体心结构,所以这种铁单质的晶胞为体心结构,并且 ![]() 单质的晶胞参数为
单质的晶胞参数为 ![]() ,则面对角线长为
,则面对角线长为 ![]() ,所以体对角线长为
,所以体对角线长为 ![]() ,相距最近的两个
,相距最近的两个 ![]() 原子核间距为体对角线的一半,所以相距最近的两 个
原子核间距为体对角线的一半,所以相距最近的两 个 ![]() 原子核间距为
原子核间距为 ![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硝酸是一种重要的化工原料,工业上采用氨催化氧化法制备,生产过程中发生的反应有:
4NH3(g)+5O2(g)  4NO(g)+6H2O(l) ΔH1=-1169.2 kJ/mol
4NO(g)+6H2O(l) ΔH1=-1169.2 kJ/mol
2NO(g)+O2(g)=2NO2(g) ΔH2=-114.2 kJ/mol
3NO2(g)+H2O(l)=2HNO3(aq)+NO(g) ΔH3=-71.7kJ/mol
回答下列问题:
(1)NH3(g)+2O2(g)=HNO3(aq)+H2O(l)的ΔH=___________kJ/mol。
原料气体(NH3、O2)在进入反应装置之前,必须进行脱硫处理。其原因是________。
(2)研究表明2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
(a)2NO(g) ![]() N2O2(g)(快) (b)N2O2(g)+O2(g)
N2O2(g)(快) (b)N2O2(g)+O2(g) ![]() 2NO2(g) (慢)
2NO2(g) (慢)
①该反应的速率由b步决定,说明b步反应的活化能比a步的_____(填“大”或“小”)。
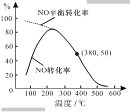
②在恒容条件下,NO和O2的起始浓度之比为2:1,反应经历相同时间,测得不同温度下NO转化为NO2的转化率如右图,则150℃时,v正____v逆(填“>”或“<”)。若起始c(O2)=5.0×104mol·L1,则380℃下反应达平衡时c(O2)=_______ mol·L1。
(3)T1温度时,在容积为2L的恒容密闭容器中发生反应2NO+O2=2NO2,实验测得:v正=v(NO)消耗=2v(O2)消耗=k正c2(NO)c(O2),v逆=v(NO2)消耗=k逆c2(NO2),k正、k逆为速率常数,受温度影响。容器中各反应物和生成物的物质的量随时间变化如图所示:
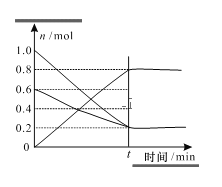
①下列说法能表明该反应已经达到平衡状态的是_______(填序号)
A.混合气体的密度不变
B.混合气体的颜色不变
C.k正、k逆不变
D.2v正(O2)=v逆(NO2)
②化学平衡常数K与速率常数k正、k逆的数学关系式K=___________。
③温度为T1时的化学平衡常数K=_________。若将容器的温度变为T2时k正=k逆,则T2 _______T1(填“>” “<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )

A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,钢铁轮船外壳连接一块金属A(铜块)可以减缓船体外壳腐蚀速度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和 去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是
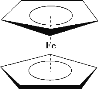
A.1mol 环戊二烯( ![]() )中含有σ键的数目为1NA
)中含有σ键的数目为1NA
B.环戊二烯中碳原子的杂化方式有 sp3 和 sp2
C.二茂铁属于分子晶体
D.二茂铁分子中的化学键有极性共价键、非极性共价键和配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是( )
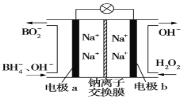
A.电池放电时Na+从b极区移向a极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.每消耗1molH2O2,转移的电子为1mol
D.该电池的正极反应为:BH4-+8OH--8e-=BO2-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是 ( )


A. 用图1装置处理银器表面的黑斑(Ag2S),银器表面发生的反应为Ag2S+2e-=2Ag+S2-
B. 用图2装置电解一段时间后,铜电极部分溶解,溶液中铜离子的浓度基本不变
C. 图3装置中若直流电源的X极为负极,则该装置可实现粗铜的电解精炼
D. 图4装置中若M是铜,则该装置能防止铁被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铁的化合物在工业生产和日常生活中都有广泛的用途。请回答下列问题:
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:___。
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。

①此装置中爱迪生蓄电池的负极是___(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是___。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-浓度与去除率的关系。下列说法不正确的是( )
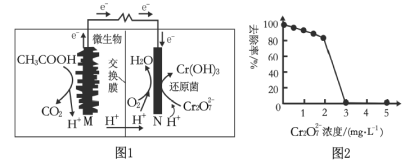
A.图1燃料电池工作一段时间后,N极附近的溶液pH增大
B.外电路转移2 mol电子时,N极消耗标准状况下11.2 L O2
C.图2中Cr2O72-浓度较大时,其去除率下降可能是Cr2O72-浓度较大造成还原菌失活所致
D.M极为电池负极,发生的电极反应为CH3COOH+2H2O-8e-=2CO2↑+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. NCl3分子是非极性分子
C. NBr3比NCl3易挥发
D. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com