
����Ŀ��һ�ּ״�ȼ�ϵ�ز��ò����缫����,����е����ӽ���Ĥֻ�������Ӻ�ˮ����ͨ�����乤��ԭ����ʾ��ͼ:
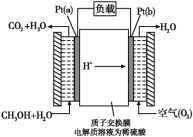
��ش���������:
��1��Pt(a)�缫��ӦΪ________;����õ�ع���ʱ��·��ͨ��2mol����,�����ĵ�CH3OH��________mol��
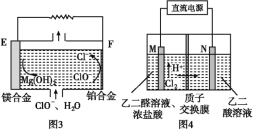
��2��þȼ�ϵ���ڿ��ƶ������豸��Դ�ͱ��õ�Դ�ȷ���Ӧ��ǰ��������ͼ3Ϊ��þ������������ȼ�ϵ��ԭ��ʾ��ͼ,�缫Ϊþ�Ͻ�Ͳ��Ͻ�EΪ��ȼ�ϵ�ص�________(����������������)����F�缫�ϵĵ缫��Ӧʽ________��
��3����ȩ��(HOOC��CHO)���л��ϳɵ���Ҫ�м��塣��ҵ������˫���ҳɶԵ�ⷨ��������ȩ��,ԭ����ͼ4��ʾ,��װ��������������Ϊ���Ե缫,�����Ҿ��ɲ�����ȩ��,�����Ҷ�ȩ(OHC��CHO)��M�缫�IJ��ﷴӦ������ȩ�ᡣ
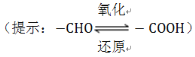
��N�缫�ϵĵ缫��ӦʽΪ________��
����2molH+ͨ�����ӽ���Ĥ,����ȫ�����˷�Ӧ,���װ�������ɵ���ȩ��Ϊ________mol��
���𰸡�CH3OH+H2O-6e-CO2��+6H+ ![]() �� ClO-+2e��+H2OCl-+2OH�� HOOC��COOH+2e��+2H+=HOOC-CHO+H2O 2
�� ClO-+2e��+H2OCl-+2OH�� HOOC��COOH+2e��+2H+=HOOC-CHO+H2O 2
��������
(1)ȼ�ϵ���У�ͨ��ȼ�ϵĵ缫Ϊ������������ʧȥ���ӷ���������Ӧ������������ԭ��Ӧ��ʧ���ӹ��ɽ��м��㣻
(2)��ʾ��ͼ��֪����þ������������ȼ�ϵ����ʧ���ӵ�Ϊ��������þ�Ͻ�Ϊ�������缫��ӦʽΪMg-2e-��2OH-===Mg(OH)2�����Ͻ�Ϊ������������ClO���õ������������ӣ��������ĵ缫��ӦʽΪClO��+2e��+H2O===Cl��+2OH����
(3)����H+���ƶ������֪��M�缫��������Cl-�������Ϸ���ʧ���ӵ�������Ӧ����Cl2���缫��ӦʽΪ2Cl--2e-===Cl2����N�缫Ϊ������HOOC-COOH�������ϵõ��ӷ�����ԭ��Ӧ����HOOC-CHO���缫��ӦʽΪHOOC-COOH+2e-+2H+===HOOC-CHO+H2O��
(1)��װ��ͼ��֪���������ҺΪ������Һ��ȼ�ϵ���У�ͨ��ȼ�ϵĵ缫Ϊ��������Pt(a)�Ǹ�����ʧȥ���ӷ���������Ӧ���缫��ӦʽΪCH3OH+H2O-6e-CO2��+6H+�����ݵ缫����ʽ��֪����·��ͨ��2mol����ʱ�����ĵ�CH3OH�����ʵ���Ϊ![]() mol���ʴ�Ϊ��CH3OH+H2O-6e-CO2��+6H+��
mol���ʴ�Ϊ��CH3OH+H2O-6e-CO2��+6H+��![]() ��
��
(2)��ʾ��ͼ��֪����þ������������ȼ�ϵ���У�EΪþ�Ͻ�Ϊȼ�ϵ�صĸ�����FΪ���Ͻ�Ϊ������������ClO���õ������������ӣ��������ĵ缫��ӦʽΪClO��+2e��+H2O===Cl��+2OH�����ʴ�Ϊ������ClO-��2e-��H2O===Cl-��2OH-��
(3)��N�缫Ϊ���ص�������HOOC-COOH�������ϵõ��ӷ�����ԭ��Ӧ����HOOC-CHO���缫��ӦʽΪHOOC-COOH+2e-+2H+===HOOC-CHO+H2O���ʴ�Ϊ��HOOC-COOH+2e-+2H+===HOOC-CHO+H2O��
��2mol H+ͨ�����ӽ���Ĥ��������ת��2mol���ӣ����ݵ缫����ʽHOOC-COOH+2e-+2H+===HOOC-CHO+H2O����֪��������1mol��ȩ�������M�����缫��ӦʽΪ2Cl--2e-===Cl2�����Ҷ�ȩ��Cl2�ķ�ӦΪCl2+OHC��CHO+H2O===HOOC��CHO+2HCl���������������������ʧ������ȣ�����Ҳ����1mol��ȩ���������������ȩ�����ɣ��������ɵ���ȩ��Ϊ2mol���ʴ�Ϊ��2��


 ������ӱ������ͯ������ϵ�д�
������ӱ������ͯ������ϵ�д� A�ӽ��� ϵ�д�
A�ӽ��� ϵ�д� ȫ�Ų��Ծ�ϵ�д�
ȫ�Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʴ�йص�˵����ȷ����( )

A. ͼa�У����뺣ˮ�е�������Խ�����˸�ʴԽ����
B. ͼb�У�������M������Nʱ��Cu-Zn�Ͻ�ĸ�ʴ���ʼ�С
C. ͼc�У���ͨ����ʱZn��ʴ��������Zn�Ϸų����������Ҳ����
D. ͼd�У������ִ��������һ�����A(ͭ��)���Լ���������Ǹ�ʴ�ٶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ļ������ڹ�ҵ�������ճ������ж��й㷺����;����ش��������⣺
��1��������ʴ��Ŀǰ���Խ������ʵ���⣬�绯ѧ��ʴ��Ϊ�ձ顣д���ڳ�ʪ�����и�����ʴʱ������ԭ��Ӧ�ĵ缫��Ӧʽ��___��
��2�����������صķ�ӦʽΪFe��NiO2��2H2O![]() Fe(OH)2��Ni(OH)2����������(Na2FeO4)��һ�����;�ˮ��������ͼװ�ÿ�����ȡ�����������ơ�
Fe(OH)2��Ni(OH)2����������(Na2FeO4)��һ�����;�ˮ��������ͼװ�ÿ�����ȡ�����������ơ�

�ٴ�װ���а��������صĸ�����___(����a������b��)���õ�ع���һ��ʱ�������磬���ʱ����NiO2�ķ�Ӧ������___��
��д�����õ�ⷨ��ȡ��������ʱ�������ĵ缫��Ӧʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ�ؿɾ�����ˮ��ͬʱ���ܻ����Դ���м�ֵ�Ļ�ѧ��Ʒ��ͼ1Ϊ�乤��ԭ����ͼ2Ϊ��ˮ��Cr2O72��Ũ����ȥ���ʵĹ�ϵ������˵������ȷ���ǣ� ��
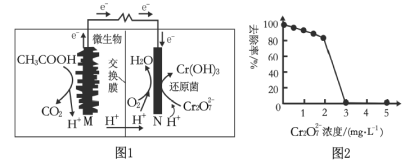
A.ͼ1ȼ�ϵ�ع���һ��ʱ���N����������ҺpH����
B.���·ת��2 mol����ʱ��N�����ı�״����11.2 L O2
C.ͼ2��Cr2O72��Ũ�Ƚϴ�ʱ����ȥ�����½�������Cr2O72��Ũ�Ƚϴ���ɻ�ԭ��ʧ������
D.M��Ϊ��ظ����������ĵ缫��ӦΪCH3COOH��2H2O��8e����2CO2����8H��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼�dz�����Ԫ�أ��䵥�ʼ������������������������Ҫ��Դ���ʡ���ش��������⣺
��1���л���M����̫������տ�ת����N��ת�����̣�
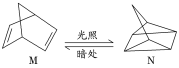
��H����88.6kJ��mol��1����M��N��ȣ����ȶ�����_____��
��2����֪CH3OH(l)��ȼ������H����726.5kJ��mol��1��CH3OH(l)��![]() O2(g)===CO2(g)��2H2(g)��H����akJ��mol��1����a________726.5(����>����<����������)��
O2(g)===CO2(g)��2H2(g)��H����akJ��mol��1����a________726.5(����>����<����������)��
��3������͵�������ı������������ʡ���ʯī�����ۺͶ������Ѱ�һ����������ڸ��������գ��������ʿ������²��ϣ�4Al(s)��3TiO2(s)��3C(s)===2Al2O3(s)��3TiC(s) ��H����1176kJ��mol��1����Ӧ�����У�ÿת��1mol���ӷų�������Ϊ________��
��4��ú�����ƺϳ���(CO��H2)
��֪:��C(s)+H2O(g)CO(g)+H2(g)��H1=��131.3kJ��mol-1
��C(s)+2H2O(g)CO2(g)+2H2(g)��H2=��90kJ��mol-1
��һ����̼��ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��µķ�ӦΪSO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ��H=��98 kJ��mol-1����ʼʱ��100 L���ܱ������м���4.0 mol SO2(g)��10.0 mol O2(g)������Ӧ�ﵽƽ��ʱ���ų�����196 kJ�����¶��£��÷�Ӧ��ƽ�ⳣ��Ϊ
SO3(g) ��H=��98 kJ��mol-1����ʼʱ��100 L���ܱ������м���4.0 mol SO2(g)��10.0 mol O2(g)������Ӧ�ﵽƽ��ʱ���ų�����196 kJ�����¶��£��÷�Ӧ��ƽ�ⳣ��Ϊ
A.1B.3C.![]() D.
D.![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ����С���о���������������ʱ���ı�ijһ�����Ի�ѧƽ���Ӱ�죬�õ����±仯����(ͼ��p��ʾѹǿ��T��ʾ�¶ȣ�n��ʾ���ʵ���)��
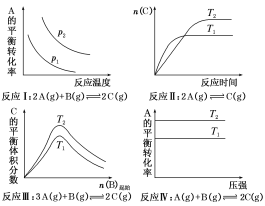
�������Ϲ����жϣ����н�����ȷ����(����)
A.��Ӧ������H��0��p2��p1B.��Ӧ������H��0��T1��T2
C.��Ӧ������H��0��T2��T1����H��0��T2��T1D.��Ӧ������H��0��T2��T1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ������£�NCl3��һ����״Һ�壬����ӿռ乹����NH3���ƣ����ж�NCl3��NH3���й�������ȷ����( )
A. ������N��Cl��������CCl4������C��Cl���������
B. NCl3�����ǷǼ��Է���
C. NBr3��NCl3�ӷ�
D. �ڰ�ˮ�У���NH3��H2O�����(����������ʾ)����γ�NH3��H2O���ӣ���NH3��H2O�ĽṹʽΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.�������(CH4)ʧȥһ��H+���γɼ�������(CH3-)���仯���������ļ��Ƿ����˸ı䣬��̼ԭ�ӵ��ӻ�����û�иı�
B.����ɱ����Ƿ��Ӿ��壬�侧���з��ӵĿռ����з�ʽ����
C.��ΪH2SO3��H2CO3�ķ��ǻ���ԭ�Ӳ�ͬ���������ǵ����Բ�ͬ
D.����[CH3CH(OH)COOH]��������2������̼ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com