
【题目】下列叙述正确的是( )
A.甲烷分子(CH4)失去一个H+,形成甲基阴离子(CH3-),变化过程中微粒的键角发生了改变,但碳原子的杂化类型没有改变
B.冰与干冰都是分子晶体,其晶胞中分子的空间排列方式类似
C.因为H2SO3和H2CO3的非羟基氧原子不同,所以它们的酸性不同
D.乳酸[CH3CH(OH)COOH]分子中有2个手性碳原子
【答案】A
【解析】
A.甲烷分子为正四面体结合,当CH4失去一个H+,形成甲基阴离子CH3-,微粒空间构型变为三角锥形,碳原子上含有孤电子对,孤电子对对成键电子对的排斥作用大于成键电子对的排斥作用,使键角比甲烷的小,但碳原子的杂化类型没有改变,仍然为sp3杂化,A正确;
B.尽管冰与干冰都是分子晶体,冰晶胞: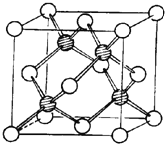 ;干冰晶胞:
;干冰晶胞: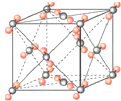 ,即冰晶胞中水分子的空间排列方式与干冰胞不同,B错误;
,即冰晶胞中水分子的空间排列方式与干冰胞不同,B错误;
C.H2SO3和H2CO3的非羟基氧原子相同,由于S原子半径大于C原子,对电子的吸引能力较弱,使电子容易失去,因而酸性:H2SO3>H2CO3,C错误;
D.乳酸[CH3CH(OH)COOH]分子中只有与-CH3、-OH、-COOH及H原子连接的C原子为手性碳原子,所以乳酸分子中只含有1个手性碳原子,D错误;
故合理选项是A。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】一种甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图:
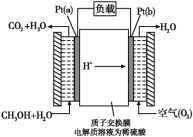
请回答下列问题:
(1)Pt(a)电极反应为________;如果该电池工作时电路中通过2mol电子,则消耗的CH3OH有________mol。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图3为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的________(填“正”或“负”)极。F电极上的电极反应式________。
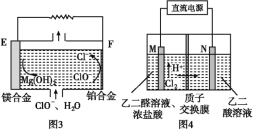
(3)乙醛酸(HOOC—CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图4所示,该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛(OHC—CHO)与M电极的产物反应生成乙醛酸。
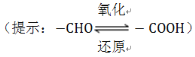
①N电极上的电极反应式为________。
②若2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某常见微粒X的结构模型可表示为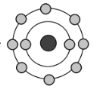 (
(![]() 代表电子),下列有关X的说法正确的是( )
代表电子),下列有关X的说法正确的是( )
A.微粒X的组成元素不可能是第三周期元素
B.X的组成元素一定是氖元素
C.若X的组成元素原子的核电荷数为8,则X是![]()
D.若X的核内质子数比电子数多,则X最多有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Phenolphthalein是常用酸碱指示剂,其结构如图所示。有关该有机物说法正确的是
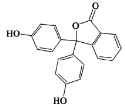
A.分子式为C20H12O4
B.含有的官能团有羟基、酯基、羧基
C.可以发生取代反应、加成反应和氧化反应
D.1mol该物质与H2和溴水反应,消耗H2和Br2的最大值分别为10mol和4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M被广泛用于医药、香料的合成,其一种合成路线如下(反应试剂与反应条件已省略)
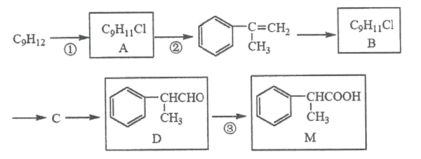
已知A与B互为同分异构体。
(1)1molD最多能与______molH2发生加成反应。
(2)反应①所需的试剂和条件是____________,反应③的反应类型是____________。
(3)反应②的化学方程式是____________。
(4)写出检验D已经完全转化为M的方法____________。
(5)写出一种符合下列要求的M的同分异构体的结构简式____________。
i. 苯环上的一氯代物只有两种 ii. 能发生水解反应 iii. 分子中含有两个甲基
(6)写出以![]() 和
和![]() 为原料制备
为原料制备![]() 的合成路线流程图。
的合成路线流程图。
已知:![]()
___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
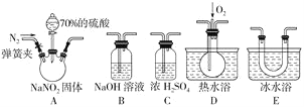
已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法不正确的是
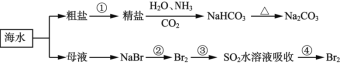
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.侯氏制碱应先通NH3再通CO2
C.在第②、③、④步骤中,溴元素均被氧化
D.③④的目的是进行溴的富集
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c在周期表中的相对位置如图所示,下列有关这三种元素的叙述正确的是
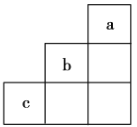
A.b的氢化物很稳定
B.a是一种活泼的非金属元素
C.c的最高价氧化物对应的水化物是弱酸
D.b的单质不能与H2O反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,![]() 可以衰变为
可以衰变为![]() ,则可用来比较这两种元素金属性强弱的方法是( )
,则可用来比较这两种元素金属性强弱的方法是( )
A.比较这两种元素的单质的熔点
B.向氯化铝和氯化镁的溶液中分别滴加过量的氨水
C.将打磨过的镁带和铝片分别与试管中的热水作用,并滴入酚酞溶液
D.将打磨过的铝片和镁带分别投入氢氧化钠溶液中,Al能与![]() 溶液反应放出氢气,而Mg不能
溶液反应放出氢气,而Mg不能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com