
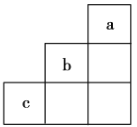
【题目】短周期元素a、b、c在周期表中的相对位置如图所示,下列有关这三种元素的叙述正确的是
A.b的氢化物很稳定
B.a是一种活泼的非金属元素
C.c的最高价氧化物对应的水化物是弱酸
D.b的单质不能与H2O反应
【答案】A
【解析】
由短周期中元素a、b、c在周期表中的位置可知,a为He元素,b为F元素,c为S元素。
A. 非金属性越强,对应氢化物越稳定;
B. He的化学性质稳定;
C. 硫酸属于强酸;
D. F2与水反应产生HF和O2。
由短周期中元素a、b、c在周期表中的位置可知,a为He元素,b为F元素,c为S元素。
A. F元素非金属性最强,对应氢化物很稳定,A正确;
B. He原子最外层为稳定结构,化学性质不活泼,B错误;
C. c的最高价氧化物的水化物是硫酸,硫酸是二元强酸,C错误;
D. F2与水剧烈反应产生HF和O2,反应方程式为2F2+2H2O=4HF+O2,D错误;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. NCl3分子是非极性分子
C. NBr3比NCl3易挥发
D. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.甲烷分子(CH4)失去一个H+,形成甲基阴离子(CH3-),变化过程中微粒的键角发生了改变,但碳原子的杂化类型没有改变
B.冰与干冰都是分子晶体,其晶胞中分子的空间排列方式类似
C.因为H2SO3和H2CO3的非羟基氧原子不同,所以它们的酸性不同
D.乳酸[CH3CH(OH)COOH]分子中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①BaCl2、②金刚石、③醋酸钠、④Na2SO4、⑤干冰、⑥碘六种物质,按下列要求回答问题:
(1)熔化时不需要破坏化学键的是______(填序号,下同),熔化时需要破坏共价键的是______,熔点最高的是______,熔点最低的是______。
(2)属于离子晶体的是______(填序号,下同),只含有离子键的物质是______。
(3)①的电子式是______,⑤的电子式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学学习小组设计了相关实验来探究元素周期律。该组同学为验证卤素单质氧化性的相对强弱,用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
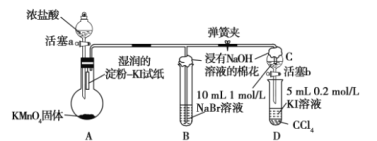
实验过程及现象:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸;
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹;
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a;
Ⅳ.打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D振荡,静置后![]() 层溶液变为紫红色。
层溶液变为紫红色。
请回答下列有关问题。
(1)B中溶液由黄色变为棕红色时发生反应的离子方程式为______。
(2)验证氯气的氧化性强于碘的实验现象是______。
(3)B和C仪器口放置浸有![]() 溶液的棉花的作用是______。
溶液的棉花的作用是______。
(4)由此实验得出的结论:同主族元素从上到下,原子的得电子能力逐渐______(填“减弱”或“增强”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】祖母绿是四大名贵宝石之一,主要成分为Be3Al2Si6O18,含有微量的Cr、Ni、Fe元素而呈现各种颜色。回答下列问题:
(1)基态Ni2+的电子排布式为____;宝石中Si的化合价是____;基态Al原子电子占据最高能级的电子云轮廓图形状为____。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有____。(填字母)
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。
①Cr(CO)6的晶体类型是____,1 mol Cr(CO)6含δ键的数目为____;
②加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的作用力类型为____。
a.离子键 b.配位键 c.金属键 d.分子间作用力
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用Δ表示),它与中心离子的电子排布结构、电荷、配体有关。试判断分裂能Δ[Fe(H2O)6]3+____Δ[Fe(H2O)6]2+(填“>”“<”或“=”),理由是_________。
(5)①氧化镍晶胞如图甲所示,A的原子坐标参数为:(0,0,![]() ),则底面面心B的原子坐标参数为____。
),则底面面心B的原子坐标参数为____。

②按图乙所示无限拓宽延长,NiO可形成“单层分子”,氧离子和镍离子均看成球体,其半径分别为a pm、b pm,“单层分子”截割出的最小重复结构单元在空间呈长方体,则离子在长方体内的空间利用率为____(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯(简称PC)是重要的工程塑料,某种PC塑料(N)的合成路线如下:
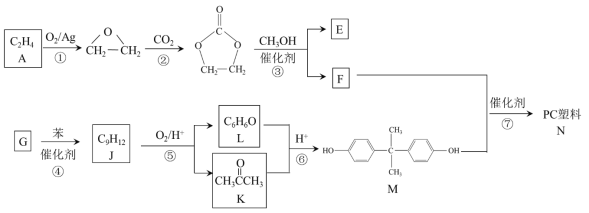
已知:R1COOR2 + R3OH![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)①的反应类型是_______________。 K中含有的官能团名称是_______________。
(2)E的名称是_______________。
(3)④是加成反应,G的核磁共振氢谱有三种峰,G的结构简式是__________________。
(4)⑦的化学方程式是______________________________________________。
(5)⑥中还有可能生成分子式为C9H12O2产物。分子式为C9H12O2且符合下列条件的同分异构体共有__________ 种。写出其中两种核磁共振氢谱有5组峰的物质的结构简式_______________________________
a.属于芳香化合物 ,且苯环上只有两个取代基 b.1mol该物质能消耗1molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对一种废旧合金(含有Cu、Fe、Si等元素)进行分离、回收再利用,所设计工艺流程如图。
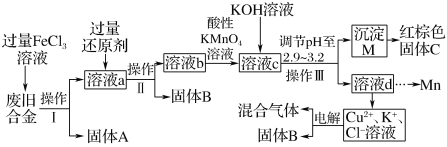
已知:298K时,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Mn(OH)2]=1.9×10-13
回答下列问题:
(1)操作Ⅰ、Ⅱ、Ⅲ为__,固体B为__(填化学式)。
(2)加入过量FeCl3溶液过程中与较不活泼的金属反应的离子方程式__。
(3)调节pH至2.9~3.2的目的是分离__(填离子符号)
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为__。
②若用amol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液VmL,所得红棕色固体C的物质的量为__(用含a、V的代数式表示)
(5)用惰性电极电解时阳极产生标准状况下的气体6.72L,阴极得到的电子数为0.8NA,则生成氧气的物质的量为__mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中,有关微粒的物质的量浓度关系不正确的是
A.0.1mol/L的NaA溶液和0.1mol/L的HA溶液等体积混合pH=4.75,则溶液:c(HA)+c(H+)=c(OH-)+c(A-)
B.0.1mol·L-1(NH4)2Fe(SO4)2溶液:c(NH4+)+2c(Fe2+)+c(H+)=2c(SO42-)+c(OH-)
C.分别用pH=2和pH=3的CH3COOH溶液中和含等物质的量NaOH的溶液,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va<Vb
D.等物质的量浓度的①NH4Cl溶液②(NH4)2SO4溶液③NH4HSO4溶液④(NH4)2CO3溶液⑤NH4HCO3中NH4+浓度的大小关系是②>④>③>①>⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com