
【题目】祖母绿是四大名贵宝石之一,主要成分为Be3Al2Si6O18,含有微量的Cr、Ni、Fe元素而呈现各种颜色。回答下列问题:
(1)基态Ni2+的电子排布式为____;宝石中Si的化合价是____;基态Al原子电子占据最高能级的电子云轮廓图形状为____。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有____。(填字母)
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.氯化物的水溶液pH均小于7
(3)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。
①Cr(CO)6的晶体类型是____,1 mol Cr(CO)6含δ键的数目为____;
②加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的作用力类型为____。
a.离子键 b.配位键 c.金属键 d.分子间作用力
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用Δ表示),它与中心离子的电子排布结构、电荷、配体有关。试判断分裂能Δ[Fe(H2O)6]3+____Δ[Fe(H2O)6]2+(填“>”“<”或“=”),理由是_________。
(5)①氧化镍晶胞如图甲所示,A的原子坐标参数为:(0,0,![]() ),则底面面心B的原子坐标参数为____。
),则底面面心B的原子坐标参数为____。

②按图乙所示无限拓宽延长,NiO可形成“单层分子”,氧离子和镍离子均看成球体,其半径分别为a pm、b pm,“单层分子”截割出的最小重复结构单元在空间呈长方体,则离子在长方体内的空间利用率为____(列出计算式即可)。
【答案】1s22s22p63s23p63d8 +4 哑铃形或纺锤形 BD 分子晶体 12NA b > Fe3+的3d轨道达半充满稳定状态,Fe2+的3d轨道未达半充满稳定状态 (![]() ,
,![]() ,0)
,0) 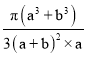 ×100%
×100%
【解析】
(1)28号Ni元素的原子失去最外层2个电子形成Ni2+,根据构造原理可得出基态Ni2+的核外电子排布式;根据化合物中元素化合价代数和等于0,结合元素化合价与原子结构关系分析判断Si元素化合价;根据Al原子核外电子排布式基态Al原子电子占据最高能级,然后确定其电子云轮廓图形状;
(2)A.根据元素在周期表的位置及周期表的划分分析;
B.根据元素的非金属性越强,其电负性越大判断,元素的金属性越强,其电负性越小;
C.同一周期元素的第一电离能随原子序数的增大而增大,但第IIA、第VA大于相邻元素;
D.根据盐的组成,结合盐的水解规律分析;
(3)根据分子晶体的熔沸点比较低进行判断;结合络合物的构成微粒的结构分析含有的化学键类型及数目,利用化学反应过程就是旧化学键断裂,新化学键形成的过程判断物质反应破坏的化学键类型;
(4)根据Fe2+、Fe3+含有的价层电子排布,结合离子的能量、稳定性分析;
(5)①根据A点的坐标及与B点的相对位置确定B点的坐标;
②图乙结构单元中含有镍离子数目为10,根据电荷守恒可确定氧离子的数目,根据几何知识可知:最近的2个O2-核间距为(2a+2b)pm×![]() =
=![]() (a+b)pm;可得结构单元中长方体的各个棱长,利用空间利用率=
(a+b)pm;可得结构单元中长方体的各个棱长,利用空间利用率=![]() 计算。
计算。
(1)根据构造原理可知:28号Ni元素的原子核外电子排布式是1s22s22p63s23p63d84s2,Ni原子失去最外层4s能级的2个电子形成Ni2+,核外电子排布式是1s22s22p63s23p63d8;祖母绿主要成分为Be3Al2Si6O18,由于Be为+2价,Al为+3价,O为-2价,且化合物中所有元素化合价代数和等于0,假设Si元素化合价为+x,则3×(+2)+2×(+2)+6x=18×(-2),解得x=+4价;Al是13号元素,原子核外电子排布式是1s22s22p63s23p1,可见Al原子核外电子占据最高能级为3p能级,3p电子云轮廓图形状为纺锤形或哑铃形;
(2)A. Be元素位于元素周期表第二周期第IIA,原子核外最外层电子排布为2s2,属于s区元素,A错误;
B. 同一主族的元素,原子序数越大,元素的金属性越强;同一周期的元素,原子序数越大,元素的金属性越弱,则Be、Al的金属性都比镁弱;元素的金属性越强,其电负性越小,则Be、Al的电负性都比Mg的大,B正确;
C. Be、Mg都是第IIA的元素,原子半径Be<Mg,则第一电离能Be>Mg;Mg、Al是同一周期的元素,由于Mg原子最外层电子处于轨道的全充满的稳定状态,所以第一电离能:Mg>Al,C错误;
D. BeCl2、AlCl3都是强酸弱碱盐,在水溶液中金属阳离子水解使溶液显酸性,所以氯化物的水溶液pH均小于7,D正确;
故合理选项是BD;
(3)①六羰基铬[Cr(CO)6]的沸点为220℃,比较低,是由于Cr(CO)6是由分子构成的,物质的分子之间通过微弱的分子间作用力结合,物质的晶体类型是分子晶体;Cr(CO)6是络合物,在每个配位体CO中含有1个δ键、2个π键,中心Ni原子与6个配位体CO形成6个配位键,配位键是δ键、所以1个Cr(CO)6含δ键数目为6+6=12,则1 mol Cr(CO)6含δ键的数目为12NA;
②加热Cr(CO)6可得到高纯度铬粉和CO,由于配位体CO与中心Cr原子之间通过配位键结合,所以该反应发生时破坏的作用力类型为配位键,合理选项是b;
(4)Fe是26号元素,Fe原子失去最外层2个电子形成Fe2+,Fe2+核外电子排布式是1s22s22p63s23p63d6,其
(5)①由于A点坐标为(0,0,![]() ),A点处于晶胞的棱心,B点处于底面的面心,可知B点坐标为(
),A点处于晶胞的棱心,B点处于底面的面心,可知B点坐标为(![]() ,
,![]() ,0);
,0);
②图乙中含有Ni2+数目是10,由电荷守恒可知结构单元中含有O2-数目为10,Ni、O原子总体积为V(原子)=10×![]() π(
π(![]() +
+![]() ),根据几何知识可知:最近的两个O2-的核间距为(2a+2b)pm×
),根据几何知识可知:最近的两个O2-的核间距为(2a+2b)pm×![]() =
=![]() (a+b)pm,结构单元长方体的长=5
(a+b)pm,结构单元长方体的长=5![]() (a+b)pm,宽为2
(a+b)pm,宽为2![]() (a+b) pm,高为2a pm,因此原子空间利用率为
(a+b) pm,高为2a pm,因此原子空间利用率为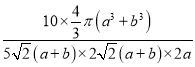 ×100%=
×100%=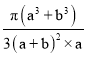 ×100%。
×100%。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:
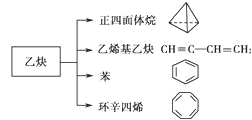
下列说法正确的是( )
A.1mol乙烯基乙炔能与 3mol Br2发生加成反应
B.正四面体烷二氯取代产物有2种
C.环辛四烯核磁共振氢谱有2组峰
D.环辛四烯与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。

已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c在周期表中的相对位置如图所示,下列有关这三种元素的叙述正确的是
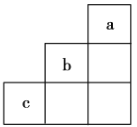
A.b的氢化物很稳定
B.a是一种活泼的非金属元素
C.c的最高价氧化物对应的水化物是弱酸
D.b的单质不能与H2O反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年3月南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Mn2+的价电子排布式为____;银与铜位于同一族,银元素位于元素周期表的___区。
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体的部分结构如图1所示:
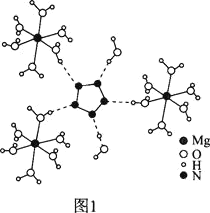
N、O、Mg元素的前3级电离能如下表所示:
元素 | I1/kJmol-1 | I2/kJmol-1 | I3/kJmol-1 |
X | 737.7 | 1450.7 | 7732.7 |
Y | 1313.9 | 3388.3 | 5300.5 |
Z | 1402.3 | 2856.0 | 4578.1 |
①X、Y、Z中为N元素的是____,判断理由是__________。
②从作用力类型看,Mg2+与H2O之间是________、N5与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是_______。科学家预测将来还会制出含N4-、N6-等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则N4-中的大π键应表示为_________。
),则N4-中的大π键应表示为_________。
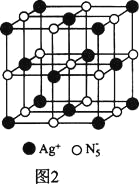
(3)AgN5的立方晶胞结构如图2所示,Ag+周围距离最近的Ag+有_______个。若晶体中紧邻的N5-与Ag+的平均距离为a nm,NA表示阿伏加德罗常数的值,则AgN5的密度可表示为_____gcm-3(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 用惰性电极电解CuSO4溶液一段时间后,若加入29.4gCu(OH)2能使溶液复原,则电解过程中转移电子的数目为0.9NA
B. 0.1molNa2O2与过量的CO2和H2O混合气体充分反应后,放出的O2为0.2NA
C. 常温常压下,1molSiO2晶体中有2NA个Si-O键
D. 18gH218O和2H2O的混合物中,所含中子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子。向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如图所示。下列有关判断正确的是 ( )
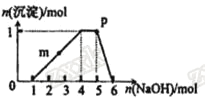
A.m点处反应:H++OH-=H2O
B.p点:c(OH-)>c(NH4+)>c(H+)
C.若取原溶液做焰色反应实验,焰色应为黄色
D.原溶液中存在的主要离子:n(H+)=2n(NH4+)=n(Al3+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:
已知化学键键能数据如表:
化学健 | C﹣H | C=O | H﹣H | C≡O(CO) | ||
键能(kJ/mol) | 413 | 745 | 436 | 1075 |
(1)①CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。则该反应的△H=_____________。
2CO(g)+2H2(g)。则该反应的△H=_____________。
②在恒容绝热条件下,一定能说明该反应已达平衡状态的是_____________。(填字母)
A.混合气体的密度不再变化B.混合气体的平均相对分子质量不再变化
C.容器内的温度不再变化D.v正(CH4)=2v逆(H2)
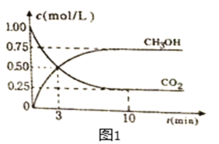
(2)利用CO2可制取甲醇,其反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);△H=-49.0KJ/mol;为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入2molCO2和6molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到平衡,v(H2)=_____________;该温度下的平衡常数数值=_____________(保留三位有效数字)。
CH3OH(g)+H2O(g);△H=-49.0KJ/mol;为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在恒温恒容密闭容器中,充入2molCO2和6molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如图1所示。从反应开始到平衡,v(H2)=_____________;该温度下的平衡常数数值=_____________(保留三位有效数字)。
(3)下列措施能使![]() 增大的是________。
增大的是________。
A.降低温度
B.恒温恒容下,再充入2molCO2、6molH2
C.使用高效催化剂
D.恒温恒容充入He(g)使体系压强增大
(4)一种熔融碳酸盐燃料电池原理示意如图2。
①该电池的负极反应式为_____________
②电池工作时,CO32﹣向电极_____________移动(填A或者B)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com