
【题目】(1)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
(i)CH4(g)+CO2(g)![]() 2CO(g)+H2(g) △H1=+247.3kJ·mol﹣1
2CO(g)+H2(g) △H1=+247.3kJ·mol﹣1
(ii)CO(g)+2H2(g)![]() CH3OH(g) △H2=﹣90.1kJ·mol﹣1
CH3OH(g) △H2=﹣90.1kJ·mol﹣1
(iii)2CO(g)+O2(g)![]() 2CO2(g) △H3=﹣566.01kJ·mol﹣1
2CO2(g) △H3=﹣566.01kJ·mol﹣1
用CH4和O2直接制备甲醇蒸气的热化学方程式为___。
(2)二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g)△H=akJmol﹣1在T1℃时,将2molSO2、1molO2充入容积为2L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3kJ,测得SO2的平衡转化率为50%,则a=___;T1℃时,上述反应的平衡常数K1=___Lmol﹣1。若将初始温度为T1℃的2molSO2和1molO2充入容积为2L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1___K2(填“>”、“<”或“=”)。
2SO3(g)△H=akJmol﹣1在T1℃时,将2molSO2、1molO2充入容积为2L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3kJ,测得SO2的平衡转化率为50%,则a=___;T1℃时,上述反应的平衡常数K1=___Lmol﹣1。若将初始温度为T1℃的2molSO2和1molO2充入容积为2L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1___K2(填“>”、“<”或“=”)。
【答案】2CH4(g)+O2(g)2CH3OH(g)△H=-251.6kJmol-1 196.6 4 >
【解析】
(1)由盖斯定律计算可得;
(2)建立三段式,依据三段式计算a和平衡常数;放热反应会导致绝热密闭容器中反应温度升高。
(1)由盖斯定律可知,(i)×2+(ii)×2+(iii)可得2CH4(g)+O2(g)2CH3OH(g)△H,故△H=2△H1+2△H2+△H3=(+247.3kJmol-1)×2+(-90.1kJmol-1)×2+(-566.0kJmol-1)=-251.6kJmol-1,则用CH4和O2直接制备甲醇蒸气的热化学方程式为CH4(g)+O2(g)2CH3OH(g)△H=-251.6kJmol-1,故答案为:2CH4(g)+O2(g)2CH3OH(g)△H=-251.6kJmol-1;
(2)由题意可知SO2的平衡转化率为50%,由此建立如下三段式:
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
开始(mol) 2 1 0
转化(mol) 1 0.5 1
平衡(mol) 1 0.5 1
因平衡时放出热量为98.3kJ,则a=2×98.3=196.6;平衡时2L的密闭容器SO2、O2、SO3的浓度依次为0.5mol/L、0.25 mol/L、0.5 mol/L、则平衡常数K=![]() =4;该反应为放热反应,在容积为2L的绝热密闭容器B中反应温度升高,升高温度,平衡向逆反应方向移动,化学平衡常数减小,则K1>K2,故答案为:196.6;4;>。
=4;该反应为放热反应,在容积为2L的绝热密闭容器B中反应温度升高,升高温度,平衡向逆反应方向移动,化学平衡常数减小,则K1>K2,故答案为:196.6;4;>。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】在20世纪90年代末,科学家发现碳有新的单质形态![]() 存在。后来人们又相继得到了
存在。后来人们又相继得到了![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是
等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是
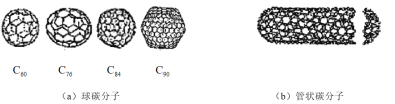
A.金刚石和石墨的熔点肯定比![]() 高
高
B.熔点:![]()
C.球碳分子、管状碳分子和洋葱状碳分子都是分子晶体,都是碳的同素异形体
D.金刚石以非分子形式的粒子存在,属于原子晶体;![]() 、
、![]() 、管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质不互为同素异形体
、管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质不互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,发生化学反应H2(g)+I2(g)![]() 2HI(g),下列选项中不能作为达到平衡的标志的是( )
2HI(g),下列选项中不能作为达到平衡的标志的是( )
A. 混合气体颜色不再变化
B. 单位时间内生成nmol氢气的同时生成nmol碘蒸气
C. 若该反应在隔热密闭体积恒定的容器中进行反应,体系的温度不再变化
D. 2v(H2)正=v(HI)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池可用作空军通信卫星电源,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是( )
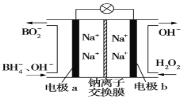
A.电池放电时Na+从b极区移向a极区
B.电极b采用MnO2,MnO2既作电极材料又有催化作用
C.每消耗1molH2O2,转移的电子为1mol
D.该电池的正极反应为:BH4-+8OH--8e-=BO2-+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组向50mLBa(NO3)2和Al(NO3)3的混合溶液M中逐滴加入K2SO4和KOH的混合溶液N,产生沉淀的物质的量(n)随加入溶液N的体积(V)变化的关系如图。下列说法错误的是( )
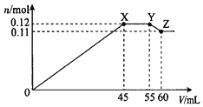
A.溶液N中K2SO4和KOH的物质的量浓度均为1molL-1
B.X点沉淀的组成为0.09molBaSO4和0.03molAl(OH)3
C.溶液M中含有0.11molBa(NO3)2和0.03molAl(NO3)3
D.Y点到Z点之间发生的化学方程式为:Al(OH)3+KOH=KAlO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铁的化合物在工业生产和日常生活中都有广泛的用途。请回答下列问题:
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:___。
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。

①此装置中爱迪生蓄电池的负极是___(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是___。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所列的“依据”能推导出后面的“结论”的是
依据 | 结论 | |
A | CH4(g)+2O2(g)CO2(g)+2H2O(g)ΔH=-801.3kJ·mol-1 | CH4的标准燃烧热ΔH为-801.3kJ·mol-1 |
B | Sn(灰,s) | 锡制品在寒冷的冬天因易转化为灰状锡而损坏 |
C | 稀溶液中:H+(aq)+OH-(aq)H2O(l)ΔH=-57.3kJ·mol-1 | 中和热ΔH为57.3kJ·mol-1 |
D | C(石墨,s)+O2(g)CO2(g)ΔH=-393.5kJ·mol-1 C(金刚石,s)+O2(g)CO2(g)ΔH=-395kJ·mol-1 | 石墨转化为金刚石会放出热量 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是常见的元素,其单质及化合物是人类生产生活的主要能源物质。请回答下列问题:
(1)有机物M经过太阳光光照可转化成N,转化过程:
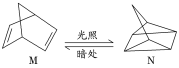
ΔH=+88.6kJ·mol-1。则M、N相比,较稳定的是_____。
(2)已知CH3OH(l)的燃烧热ΔH=-726.5kJ·mol-1,CH3OH(l)+![]() O2(g)===CO2(g)+2H2(g)ΔH=-akJ·mol-1,则a________726.5(填“>”“<”或“=”)。
O2(g)===CO2(g)+2H2(g)ΔH=-akJ·mol-1,则a________726.5(填“>”“<”或“=”)。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1176kJ·mol-1,则反应过程中,每转移1mol电子放出的热量为________。
(4)煤气化制合成气(CO和H2)
已知:①C(s)+H2O(g)CO(g)+H2(g)ΔH1=+131.3kJ·mol-1
②C(s)+2H2O(g)CO2(g)+2H2(g)ΔH2=+90kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
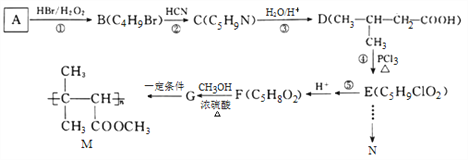
【题目】有机物N(![]() )是一种常见的有机合成中间体,在生产中用途广泛。以有机物A为原料合成M和N的路线如下所示:
)是一种常见的有机合成中间体,在生产中用途广泛。以有机物A为原料合成M和N的路线如下所示:
已知:I. ![]()
II. ![]()
请回答下列问题:
(1)A分子中共面的原子数最多为________个,-CN的电子式为_______________。
(2)②的反应类型为________________, E分子中所含官能团的名称为____________,G的结构简式为_____________________。
(3)写出反应⑤的化学方程式__________________________________________,写出M在酸性条件下水解的化学方程式_________________________________。
(4)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有______种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的一种同分异构体的结构简式:____________________。
(5)结合信息,写出用E和乙醇为原料制备化合物N的合成路线:(其他试剂任选)_____________
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com