
【题目】某学习小组向50mLBa(NO3)2和Al(NO3)3的混合溶液M中逐滴加入K2SO4和KOH的混合溶液N,产生沉淀的物质的量(n)随加入溶液N的体积(V)变化的关系如图。下列说法错误的是( )
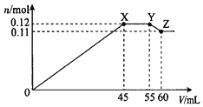
A.溶液N中K2SO4和KOH的物质的量浓度均为1molL-1
B.X点沉淀的组成为0.09molBaSO4和0.03molAl(OH)3
C.溶液M中含有0.11molBa(NO3)2和0.03molAl(NO3)3
D.Y点到Z点之间发生的化学方程式为:Al(OH)3+KOH=KAlO2+2H2O
【答案】A
【解析】
硫酸钾发生反应:Ba2++SO42-=BaSO4↓,而KOH发生反应:Al3++3OH-=Al(OH)3↓,当KOH过量时,又发生反应:Al(OH)3+OH-=AlO2-+2H2O。由45~55mL沉淀量不变,而后沉淀又减小,可知该阶段由Al(OH)3的溶解和BaSO4的继续生成所引起,且溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等,则:0~45mL阶段曲线生成的沉淀为BaSO4和Al(OH)3,且加入N溶液45mL时,Al3+恰好沉淀完全。加入N溶液55mL时,Ba2+恰好沉淀完全。55mL~60mL阶段Al(OH)3继续溶解。加入N溶液60mL时,沉淀中Al(OH)3已完全溶解。最终沉淀为BaSO4共0.11mol,据此解答。
A.0~45mL阶段曲线生成的沉淀为BaSO4和Al(OH)3,45~55mL阶段溶解的Al(OH)3的物质的量和生成的BaSO4的物质的量相等,假设溶解Al(OH)3为1mol,则生成BaSO4为1mol,由Al(OH)3+OH-=AlO2-+2H2O,可知消耗KOH为1mol,由Ba2++SO42-=BaSO4↓,可知消耗K2SO4为1mol,故溶液N中c(K2SO4):c(KOH)=1:1,55mL~60mL阶段Al(OH)3继续溶解。加入N溶液60mL时,沉淀中Al(OH)3已完全溶解,溶解0.01molAl(OH)3,c(KOH)=![]() =2mol/L,溶液N中K2SO4和KOH的物质的量浓度均为2molL-1,故A错误;
=2mol/L,溶液N中K2SO4和KOH的物质的量浓度均为2molL-1,故A错误;
B.加入K2SO4和KOH的混合溶液N45mL,溶液N中K2SO4和KOH的物质的量浓度均为2molL-1,消耗的物质的量都为2molL-1×0.045L=0.09mol,故X点沉淀的组成为0.09molBaSO4和0.03molAl(OH)3,故B正确;
C.60mL阶段沉淀中Al(OH)3已完全溶解,最终沉淀为BaSO4共0.11mol,根据钡离子守恒,溶液M中含有0.11molBa(NO3)2,根据铝原子守恒,有0.03molAl(NO3)3,故C正确;
D.Y点到Z点之间发生发生Al(OH)3溶解至完全,化学方程式为Al(OH)3+KOH=KAlO2+2H2O,故D正确;
故选:A。


科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(HF)2(g)![]() 2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
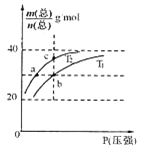
A.温度:T1< T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:v(b)>v(a)
D.当![]() 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在海洋深处的沉积物中含有大量可燃冰,主要成分是甲烷水合物。结构可以看成是甲烷分子 装在由水分子形成的笼子里。下列关于说法正确的是
A.甲烷分子和水分子的 VSEPR 模型不同
B.甲烷分子通过氢键与构成笼的水分子相结合
C.可燃冰属于分子晶体
D.水分子的键角大于甲烷分子的键角
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息填空
①某元素原子基态核外电子有 14 种不同的运动状态,该元素位于第_____周期第_____族
②外围电子排布式为 3d54s2 的原子,其原子结构示意图为_____,其最高正价为_____价
③Fe2+的价电子排布图为_____
④33 号元素的核外电子排布式简写形式为_____,属于__________区
⑤前四周期未成对电子最多的元素,其基态核外电子占据的轨道数目为_____
⑥《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3 中,阴离子空间构型为_____,C 原子的杂化形式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
(i)CH4(g)+CO2(g)![]() 2CO(g)+H2(g) △H1=+247.3kJ·mol﹣1
2CO(g)+H2(g) △H1=+247.3kJ·mol﹣1
(ii)CO(g)+2H2(g)![]() CH3OH(g) △H2=﹣90.1kJ·mol﹣1
CH3OH(g) △H2=﹣90.1kJ·mol﹣1
(iii)2CO(g)+O2(g)![]() 2CO2(g) △H3=﹣566.01kJ·mol﹣1
2CO2(g) △H3=﹣566.01kJ·mol﹣1
用CH4和O2直接制备甲醇蒸气的热化学方程式为___。
(2)二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g)△H=akJmol﹣1在T1℃时,将2molSO2、1molO2充入容积为2L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3kJ,测得SO2的平衡转化率为50%,则a=___;T1℃时,上述反应的平衡常数K1=___Lmol﹣1。若将初始温度为T1℃的2molSO2和1molO2充入容积为2L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1___K2(填“>”、“<”或“=”)。
2SO3(g)△H=akJmol﹣1在T1℃时,将2molSO2、1molO2充入容积为2L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3kJ,测得SO2的平衡转化率为50%,则a=___;T1℃时,上述反应的平衡常数K1=___Lmol﹣1。若将初始温度为T1℃的2molSO2和1molO2充入容积为2L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1___K2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
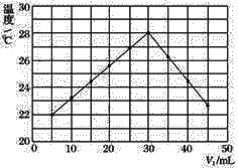
【题目】某研究小组将V1mL 1.0 mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(1)研究小组做该实验时环境温度________(填“高于”、“低于”或“等于”)22℃,判断的依据是_______。
(2)由题干及图形可知:V1∶V2=________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为______ mol·L-1。
(3)实验时将酸碱在简易量热计中混合,并用_______搅拌,使溶液混合均匀。经计算此反应共放出Q kJ的热量,请写出表示中和热的热化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国新建的某海岛发电示意图如图,已知铅蓄电池放电时的总反应为:Pb+PbO2+2H2SO4= 2PbSO4+2H2O,下列有关说法正确的是
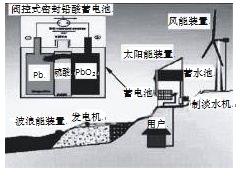
A.图中涉及的能量转化方式只有3种
B.该发电工艺可实现零排放
C.蓄电池供电时,负极的电极反应为:Pb-2e-=Pb2+
D.储能时若充电时间过长,阳极流向阴极的气体可能是H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中选择的仪器正确的是:①分离汽油和氯化钠溶液 ②从含Fe3+的自来水中到蒸馏水③分离氯化钾和二氧化锰混合物 ④从氯化钠溶液中得到氯化钠晶体

A. ①-丁 ②-丙 ③-甲 ④-乙 B. ①-乙 ②-丙 ③-甲 ④-丁
C. ①-丁 ②-丙 ③-乙 ④-甲 D. ①-丙 ②-乙 ③-丁 ④-甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com