
【题目】已知:(HF)2(g)![]() 2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
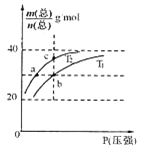
A.温度:T1< T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:v(b)>v(a)
D.当![]() 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】《斯德哥尔摩公约》禁用的12种持久性有机污染物之一是滴滴涕,其结构简式为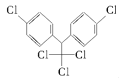 ,有关滴滴涕的说法正确的是( )
,有关滴滴涕的说法正确的是( )
A.它属于芳香烃B.分子中最多有23个原子共面
C.分子式为C14H8Cl5D.该物质不能和NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如下实验。关于该实验分析不正确的是( )
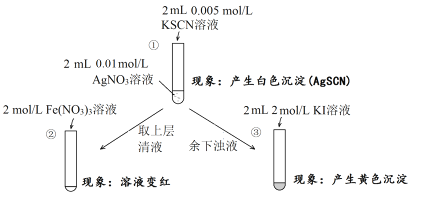
A.①浊液中存在平衡:AgSCN(s) ![]() Ag+(aq)+SCN-(aq)
Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铊是超导材料的组成元素之一,铊在周期表中位于第6周期,与铝是同族元素,元素符号是![]() 。下列对铊及其化合物的性质的推断正确的是
。下列对铊及其化合物的性质的推断正确的是
A.![]() 的金属性强于
的金属性强于![]()
B.能生成![]() 价的化合物
价的化合物
C.铊的氢氧化物的碱性比铝弱
D.![]() 与
与![]() 都具有两性
都具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在城市中地下常埋有纵横交错的管道和输电线路,有些地面上还铺有地铁或城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道或铁轨形成回路时,就会引起后者的腐蚀。原理简化如图所示。则下列有关说法不正确的是
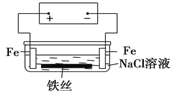
A.原理图可理解为两个串联电解装置
B.溶液中铁丝被腐蚀时,左侧有无色气体产生,附近产生少量白色沉淀,随后变为灰绿色
C.溶液中铁丝左端电极反应式为:Fe-2e-=Fe2+
D.地下管线被腐蚀,不易发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜(或油漆等)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,发生化学反应H2(g)+I2(g)![]() 2HI(g),下列选项中不能作为达到平衡的标志的是( )
2HI(g),下列选项中不能作为达到平衡的标志的是( )
A. 混合气体颜色不再变化
B. 单位时间内生成nmol氢气的同时生成nmol碘蒸气
C. 若该反应在隔热密闭体积恒定的容器中进行反应,体系的温度不再变化
D. 2v(H2)正=v(HI)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究同主族非金属元素性质的递变规律,某研究性学习小组的甲同学设计了如图所示的实验装置,其中A装置内可生成Cl2。
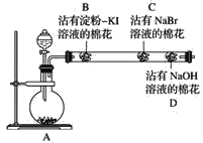
(1)甲同学的部分实验记录如下:B处棉花变成蓝色;C处棉花变成橙红色。甲同学由此现象得出的结论是同主族从上到下元素的非金属性减弱。
①B处发生反应的化学方程式为_________。
②甲同学的结论是________(填“正确”或“不正确”)的,理由是____________________。
(2)乙同学认为应将甲同学实验中B、C两处的棉花调换位置,用氯气先置换出溴,然后溴再与KI接触,以判断Br2与KI能否发生反应。该设想是________(填“合理”或“不合理”)的,原因是___
(3)丙同学在甲同学的实验结束后,取出C处的棉花,将其与另一个沾有淀粉KI溶液的棉花(E)接触,发现E慢慢出现蓝色,结合甲的实验现象,他认为可以确定同主族元素非金属性的递变规律,你同意此种观点吗?______(填“同意”或“不同意”),理由是__________
(4)丁同学综合分析了前面几位同学的实验,认为若将沾有Na2S溶液的棉花置于玻璃管中适当的位置,此实验还可以同时探究同周期元素性质的递变规律,他提出此观点的依据是___,预期的现象与结论是___________,相应反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组向50mLBa(NO3)2和Al(NO3)3的混合溶液M中逐滴加入K2SO4和KOH的混合溶液N,产生沉淀的物质的量(n)随加入溶液N的体积(V)变化的关系如图。下列说法错误的是( )
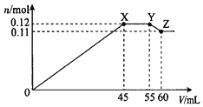
A.溶液N中K2SO4和KOH的物质的量浓度均为1molL-1
B.X点沉淀的组成为0.09molBaSO4和0.03molAl(OH)3
C.溶液M中含有0.11molBa(NO3)2和0.03molAl(NO3)3
D.Y点到Z点之间发生的化学方程式为:Al(OH)3+KOH=KAlO2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.已知:
CH3OH(l)+O2(g)=CO(g)+2H2O(g) △H1=﹣443.64kJmol﹣1
2CO(g)+O2(g)=2CO2(g) △H2=﹣566.0kJmol﹣1
下列说法或热化学方程式正确的是( )
A.CO的燃烧热为566.0kJmol﹣1
B.2molCO和1molO2的总能量比2molCO2的总能量低
C.完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3kJ
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=﹣1453.28kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com