
【题目】为探究同主族非金属元素性质的递变规律,某研究性学习小组的甲同学设计了如图所示的实验装置,其中A装置内可生成Cl2。
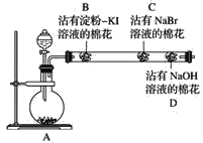
(1)甲同学的部分实验记录如下:B处棉花变成蓝色;C处棉花变成橙红色。甲同学由此现象得出的结论是同主族从上到下元素的非金属性减弱。
①B处发生反应的化学方程式为_________。
②甲同学的结论是________(填“正确”或“不正确”)的,理由是____________________。
(2)乙同学认为应将甲同学实验中B、C两处的棉花调换位置,用氯气先置换出溴,然后溴再与KI接触,以判断Br2与KI能否发生反应。该设想是________(填“合理”或“不合理”)的,原因是___
(3)丙同学在甲同学的实验结束后,取出C处的棉花,将其与另一个沾有淀粉KI溶液的棉花(E)接触,发现E慢慢出现蓝色,结合甲的实验现象,他认为可以确定同主族元素非金属性的递变规律,你同意此种观点吗?______(填“同意”或“不同意”),理由是__________
(4)丁同学综合分析了前面几位同学的实验,认为若将沾有Na2S溶液的棉花置于玻璃管中适当的位置,此实验还可以同时探究同周期元素性质的递变规律,他提出此观点的依据是___,预期的现象与结论是___________,相应反应的离子方程式为_______________。
【答案】Cl2+2KI===I2+2KCl 不正确 该实验没有验证Br2能否与KI反应,无法确定溴与碘元素的非金属性强弱 不合理 氯气不可能被NaBr消耗完,它会与溴一起到达C处 同意 甲、丙的实验分别证明了氯的非金属性比溴、碘强,溴的非金属性比碘强 氯、硫同周期 棉花变成黄色,氯元素的非金属性比硫元素强 S2-+Cl2===2Cl-+S↓
【解析】
本实验目的是探究同主族非金属元素性质的递变规律,实验原理是利用置换反应(氧化剂的氧化性强于氧化产物的氧化性),装置A制备Cl2,B中发生Cl2+2I-=I2+2Cl-,淀粉变蓝,C中发生Cl2+2Br-=Br2+2Cl-,据此分析;
(1)由B、C处产生的现象,可知B处有单质碘生成,C处有单质溴生成,①B处发生反应的化学反应方程式为Cl2+2KI=I2+2KCl;
答案为Cl2+2KI=I2+2KCl;
②结合由强生弱的反应规律可判断出氯的非金属性比溴、碘强,但因没有比较出来溴单质与碘单质氧化性的强弱,也就无法得出溴、碘两种元素非金属性的相对强弱,因此无法得出相应的结论。
答案为不正确;该实验没有验证Br2能否与KI反应,无法确定溴与碘元素的非金属性强弱;
(2)乙同学的设计不合理,氯气与NaBr溶液反应后,未反应Cl2与KI溶液接触而发生反应,因此无法比较出Br的非金属性与I的非金属性强弱;
答案为不合理;氯气不可能被NaBr消耗完,它会与溴一起到达C处;
(3)C处棉花中有液溴,与蘸有淀粉-KI溶液的棉花E后,E慢慢出现蓝色,推出有I2生成,说明Br2将I-氧化成I2,丙同学证明了溴与碘的非金属性强弱关系,结合甲同学的实验可以得出氯、溴、碘三种元素非金属性的相对强弱;
答案为同意;甲、丙的实验分别证明了氯的非金属性比溴、碘强,溴的非金属性比碘强;
(4)硫和氯属于同周期,从左向右非金属性增强,氯能置换出硫,使棉花变成黄色,发生的反应为S2-+Cl2=2Cl-+S↓;
答案为氯、硫同周期;棉花变成黄色,氯元素的非金属性比硫元素强;S2-+Cl2=2Cl-+S↓。


科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
A.2分钟反应放出的热量值小于0.1akJ
B.用氧气表示0~2min的反应速率:v(O2)=0.05mol·L-1·min-1
C.2分钟内NH3的转化率是50%
D.2分钟末c(H2O)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向 0.01 mol·L-1 的醋酸溶液中滴入 pH=7 的醋酸铵溶液,溶液 pH 随滴入醋酸铵溶液体积变化的曲线示意图如图所示。下列分析正确的是
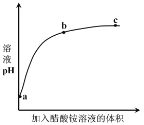
A.a点,pH = 2
B.b点,c(CH3COO-) > c(NH4+)
C.c点,pH可能大于7
D.ac段,pH的增大仅是因为醋酸电离平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(HF)2(g)![]() 2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
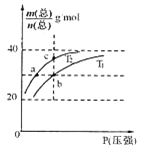
A.温度:T1< T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:v(b)>v(a)
D.当![]() 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在海洋深处的沉积物中含有大量可燃冰,主要成分是甲烷水合物。结构可以看成是甲烷分子 装在由水分子形成的笼子里。下列关于说法正确的是
A.甲烷分子和水分子的 VSEPR 模型不同
B.甲烷分子通过氢键与构成笼的水分子相结合
C.可燃冰属于分子晶体
D.水分子的键角大于甲烷分子的键角
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据信息填空
①某元素原子基态核外电子有 14 种不同的运动状态,该元素位于第_____周期第_____族
②外围电子排布式为 3d54s2 的原子,其原子结构示意图为_____,其最高正价为_____价
③Fe2+的价电子排布图为_____
④33 号元素的核外电子排布式简写形式为_____,属于__________区
⑤前四周期未成对电子最多的元素,其基态核外电子占据的轨道数目为_____
⑥《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3 中,阴离子空间构型为_____,C 原子的杂化形式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
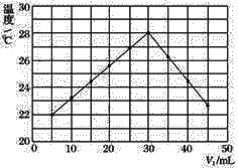
【题目】某研究小组将V1mL 1.0 mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(1)研究小组做该实验时环境温度________(填“高于”、“低于”或“等于”)22℃,判断的依据是_______。
(2)由题干及图形可知:V1∶V2=________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为______ mol·L-1。
(3)实验时将酸碱在简易量热计中混合,并用_______搅拌,使溶液混合均匀。经计算此反应共放出Q kJ的热量,请写出表示中和热的热化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)Z在元素周期表中的位置是_________________________。
(2)元素Q和R形成的化合物A是果实催熟剂,用A制备乙醇的化学方程式是_______________________。
(3)单质铜和元素M的最高价氧化物对应水化物的浓溶液发生反应的离子方程式为___________________。
(4)元素X的金属性比元素Y______(填“强”或“弱”)。
(5)元素Q、元素Z的含量影响钢铁性能,采用下图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。

①气体a的成分是________________(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com