
【题目】室温下,向 0.01 mol·L-1 的醋酸溶液中滴入 pH=7 的醋酸铵溶液,溶液 pH 随滴入醋酸铵溶液体积变化的曲线示意图如图所示。下列分析正确的是
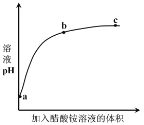
A.a点,pH = 2
B.b点,c(CH3COO-) > c(NH4+)
C.c点,pH可能大于7
D.ac段,pH的增大仅是因为醋酸电离平衡逆向移动
【答案】B
【解析】
A.由于醋酸是弱电解质,不能完全电离,所以0.01mol/的醋酸溶液中氢离子浓度小于 0.01mol/L,a点的pH大于2,A 错误;
B.所得溶液为CH3COOH和CH3COONH4 的混合溶液,CH3COONH4溶液显中性,CH3COOH溶液显酸性,所以 b 点溶液中c(H+)>c(OH﹣),根据电荷守恒可知 c(CH3COO﹣)>c(NH4+),B正确;
C.酸性的CH3COOH溶液中加入中性的CH3COONH4溶液,所得混合溶液必显酸性,即 c 点溶液的 pH 一定小于 7,C错误;
D.ac 段溶液的pH增大,不仅是因为醋酸的电离平衡逆向移动,还有溶液的稀释作用,D错误;
故选B。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】工业上用含锰废料(主要成分为MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如图所示:
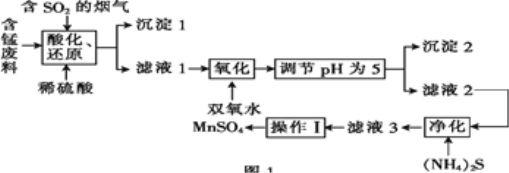
已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.3×10-33 | 4.0×10-38 | 2.2×10-20 | 1.9×10-14 |
回答下列问题:
(1)沉淀1的化学式为____。
(2)室温下,调节pH为5。试通过计算说明此时Al3+、Fe3+已沉淀完全:____。
(3)(NH4)2S的电子式为____;“净化”时,加入(NH4)2S的作用为____。
(4)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为____。
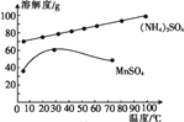
(5)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如图所示。据此判断,“操作Ⅰ”应为蒸发浓缩、____、洗涤、干燥。
(6)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的实验装置如图所示。下列关于实验操作或结论的叙述,不正确的( )
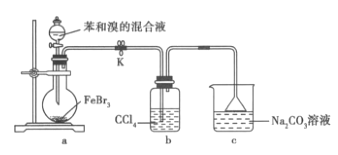
A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.实验中装置b 中的液体逐渐变为橙红色
C.若欲验证该反应为取代反应,可将c 中碳酸钠溶液更换为硝酸银溶液
D.反应结束后将a 中混合液直接倒入NaOH 溶液中,充分反应后分液并进行后续分离提纯操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如下实验。关于该实验分析不正确的是( )
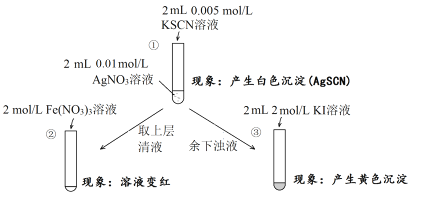
A.①浊液中存在平衡:AgSCN(s) ![]() Ag+(aq)+SCN-(aq)
Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一容积可变的密闭容器里,反应 2A(g)B(g)+2C(g)达到平衡时,A、B 和 C 的物质的量分别为 4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是( )
A.充入 1mol 稀有气体氦(He),平衡将不发生移动
B.充入A、B、C 各 1mol,平衡将向正反应方向移动
C.将 A、B、C 各物质的物质的量都减半,C 的百分含量不变
D.加入正催化剂,正逆反应速率均加快,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g) + 3H2(g) ![]() 2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量a kJ |
② | 2 | 3 | 0 | 放出热量b kJ |
③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是
A. 放出热量关系:a < b <92.4
B. 三个容器内反应的平衡常数:③>①>②
C. 达平衡时氨气的体积分数:①>③
D. N2的转化率:②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
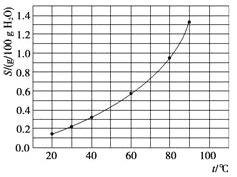
A. 溴酸银的溶解时放热过程
B. 温度升高时溴酸银溶解速度加快
C. 60 ℃时溴酸银的Ksp约等于6×10-4
D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化钡可用于制造电机电剧、光学玻璃、光导纤维、激光发生器。以钡矿粉(主要成分为BaCO3, 含有SiO2、Fe2+、Mg2+等杂质)为原料制备氟化钡的流程如下:
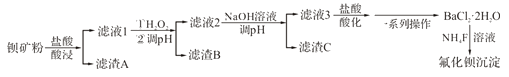
已知:常溫下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。
(1)滤渣A的化学式为_________________。
(2)滤液1加H2O2氧化的过程中主要反应的离子方程式为__________________。
(3)加20%NaOH溶液调节pH=12.5,得到滤渣C的主要成分是___________。
(4)滤液3加入盐酸酸化后再经__________、冷却结晶、__________、洗涤、真空干燥等一系列操作后得到BaCl2·2H2O。
(5)常温下,用BaCl2·2H2O配制成0.2mol·L-1水溶液与等浓度的氟化铵溶液反应,可得到氯化钡沉淀。 已知Ksp(BaF2)=1.84×l0-7,当钡离子完全沉淀时(即钡离子浓度≤10-5mol·L-1),溶液中氟离子浓度至少是____________mol·L-1。(结果保留三位有效数字,已知![]() =1.36)
=1.36)
(6)已知:Ksp(BaCO3)=2.58×10-9,Ksp(BaSO4)=1.07×10-9。将氯化钡溶液滴入等物质的置浓度的硫酸钠和碳酸钠的混合溶液中,当BaCO3开始沉淀时,溶液中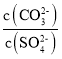 =___________(结果保留三位有效数字)。
=___________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,体积不变的密闭容器中有可逆反应A(g)+ B(g) ![]() 2C(g)+D(s),可以判断反应达到平衡是( )
2C(g)+D(s),可以判断反应达到平衡是( )
A. 单位时间内反应nmol B同时生成2nmol C
B. 容器内气体的物质的量不再变化
C. A的生成速率与B的生成速率相等
D. 容器内气体的密度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com