
【题目】实验室制备溴苯的实验装置如图所示。下列关于实验操作或结论的叙述,不正确的( )
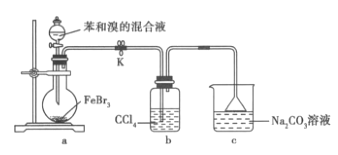
A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.实验中装置b 中的液体逐渐变为橙红色
C.若欲验证该反应为取代反应,可将c 中碳酸钠溶液更换为硝酸银溶液
D.反应结束后将a 中混合液直接倒入NaOH 溶液中,充分反应后分液并进行后续分离提纯操作
【答案】D
【解析】
在溴化铁作催化剂作用下,苯和液溴反应生成无色的溴苯和溴化氢,装置b中四氯化碳的作用是吸收挥发出的苯和溴蒸汽,装置c中碳酸钠溶液呈碱性,能够吸收反应生成的溴化氢气体,倒置漏斗的作用是防止倒吸。
A. 若关闭K时向烧瓶中加注液体,会使烧瓶中气体压强增大,苯和溴混合液不能顺利流下,打开K,可以平衡气压,便于苯和溴混合液流下,A正确;
B. 装置b中四氯化碳的作用是吸收挥发出的苯和溴蒸汽,溴溶于四氯化碳使液体逐渐变为橙红色,B正确;
C. 将c 中碳酸钠溶液更换为硝酸银溶液,硝酸银和生成的溴化氢反应生成溴化银淡黄色沉淀,可验证生成的溴化氢,则该反应为取代反应,C正确;
D. 反应后得到粗溴苯,先用水洗后再加入稀氢氧化钠溶液洗涤,除去其中溶解的溴,振荡、静置,分层后分液,向有机层中加入适当的干燥剂,然后蒸馏分离出沸点较低的苯,可以得到溴苯,D错误。
答案选D。


科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验一 碘含量的测定
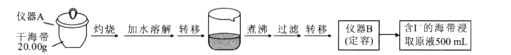
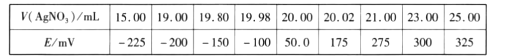
取0.0100 mol/L的 AgNO3标准溶液装入滴定管,取100.00 mL 海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中c(I-)的变化,部分数据如下表:
回答下列问题:
(1)实验中“灼烧”是在___________(填仪器名称)中完成的。
(2)用文字具体描述“定容”过程:__________________________________
(3)根据表中数据判断滴定终点时用去AgNO3溶液的体积为___________mL,计算得海带中碘的质量百分含量为_______________________%。
实验二 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
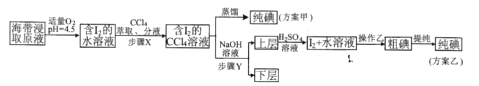
已知:3I2+6NaOH=5NaI+NaIO3+3H2O
(4)“适量O2”中能代替O2的最佳物质对应的电子式为_________________
(5)若要测定“I2+水溶液”中碘的含量,可以选择______________作指示剂,用 Na2S2O3溶液滴定,滴定终点的现象是____________________。
(6)若得到“I2+水溶液”时加入硫酸溶液过多,用Na2S2O3溶液滴定时会产生明显的误差,产生此误差的原因为_________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理烟气中的![]() 可以采用碱吸——电解法,其流程如左图:模拟过程Ⅱ如图,下列推断正确的是( )
可以采用碱吸——电解法,其流程如左图:模拟过程Ⅱ如图,下列推断正确的是( )
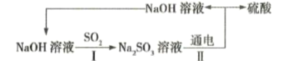
A.膜1为阴离子交换膜,膜2为阳离子交换膜
B.若用锌锰碱性电池为电源,a极与锌极相连
C.a极的电极反应式为![]()
D.若收集![]() 的P(标准状况下),则转移
的P(标准状况下),则转移![]() 电子
电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列粒子的空间构型
(1)CO2:_______________________
(2)H2S:____________
(3)SO2:___________
(4)NH4+:_________________
(5)CO32-:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;Y原子的价电子(外围电子)排布为msnmpn;②R原子核外L层电子数为奇数;③Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是________。
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的________形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为________(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为________,其中心原子的杂化类型是________。
(6)某元素原子的价电子构型为3d54s1,该元素属于________区元素,元素符号是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
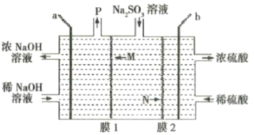
【题目】Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.
(1)①常温下Fe(CO)5呈液态,熔点为-20.5℃,沸点为103℃.据此可以判断其晶体为_________晶体,Fe(CO)5中铁的化合价为0,则该物质中含有的化学键类型有______(填字母).
A 离子键 B 极性共价键 C 非极性共价键 D 配位键
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________,配体H2O中O原子的杂化方式为________.
③NiO、FeO的晶体结构类型均与氧化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO_______FeO(填“<”或“>”).
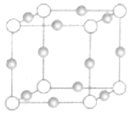
(2)Cu、N两元素形成某种化合物的晶胞结构如图(灰色球表示Cu原子),已知紧邻的白球与灰球之间的距离为acm,该晶胞的密度为________gcm-3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g)2Z(g),其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.改变压强,平衡常数不变,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向 0.01 mol·L-1 的醋酸溶液中滴入 pH=7 的醋酸铵溶液,溶液 pH 随滴入醋酸铵溶液体积变化的曲线示意图如图所示。下列分析正确的是
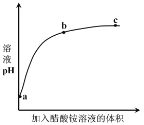
A.a点,pH = 2
B.b点,c(CH3COO-) > c(NH4+)
C.c点,pH可能大于7
D.ac段,pH的增大仅是因为醋酸电离平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新制氢氧化铜存在平衡:Cu(OH)2 + 2OH—![]() Cu(OH)42—(深蓝色)。某同学进行下列实验:
Cu(OH)42—(深蓝色)。某同学进行下列实验:
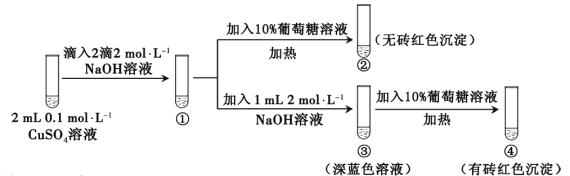
下列说法不正确的是
A. ①中出现蓝色沉淀
B. ③中现象是Cu(OH)2 + 2OH—![]() Cu(OH)42—正向移动的结果
Cu(OH)42—正向移动的结果
C. ④中现象证明葡萄糖具有还原性
D. 对比②和④可知Cu(OH)2氧化性强于Cu(OH)42—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com