
【题目】Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.
(1)①常温下Fe(CO)5呈液态,熔点为-20.5℃,沸点为103℃.据此可以判断其晶体为_________晶体,Fe(CO)5中铁的化合价为0,则该物质中含有的化学键类型有______(填字母).
A 离子键 B 极性共价键 C 非极性共价键 D 配位键
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________,配体H2O中O原子的杂化方式为________.
③NiO、FeO的晶体结构类型均与氧化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO_______FeO(填“<”或“>”).
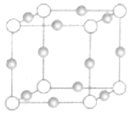
(2)Cu、N两元素形成某种化合物的晶胞结构如图(灰色球表示Cu原子),已知紧邻的白球与灰球之间的距离为acm,该晶胞的密度为________gcm-3.
【答案】分子晶体 BD 6 sp3杂化 >; ![]()
【解析】
(1)①Fe(CO)5熔沸点比较低,符合分子晶体性质;Fe与CO之间形成配位键,CO中存在极性键;
②配离子[Fe(NO)(H2O)5]2+中Fe2+是中心离子,NO、H2O是配体;H2O中O原子形成2个O-H键,含有2对孤对电子,杂化轨道数目为4;
③离子电荷相同,离子半径越小,晶格能越大,离子晶体的熔沸点越高;
(2)紧邻的白球与灰球之间的距离为acm,则晶胞棱长为2a cm,根据均摊法计算晶胞中Cu、N原子数目,表示出晶胞质量,再根据ρ=![]() 计算晶胞密度。
计算晶胞密度。
(1)①常温下Fe(CO)5呈液态,熔点为-20.5℃,沸点为103℃,符合分子晶体性质,应使用分子晶体;Fe与CO之间形成配位键,CO中存在极性键;
②配离子[Fe(NO)(H2O)5]2+中Fe2+是中心离子,NO、H2O是配体,Fe2+的配位数为6;H2O中O原子形成2个O-H键,含有2对孤对电子,杂化轨道数目为4,O原子采取sp3杂化;
③NiO、FeO的晶体结构类型均与氧化钠的相同,均属于离子晶体,离子电荷相等,而离子半径Ni2+<Fe2+,故NiO的晶格能大于FeO的,则熔点NiO>FeO;
(2)紧邻的白球与灰球之间的距离为a cm,则晶胞棱长为2a cm,晶胞中Cu原子数目为12×![]() =3、N原子数目=8×
=3、N原子数目=8×![]() =1,则晶胞质量为
=1,则晶胞质量为![]() g,则晶胞密度为
g,则晶胞密度为![]() g÷(2acm)3=
g÷(2acm)3=![]() gcm-3。
gcm-3。


科目:高中化学 来源: 题型:
【题目】元素A、B、C、D、E的原子序数依次增大,且均小于36。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;D的价电子数为2且与E同周期;E的基态原子的内部各能层均排满,且4s能级有1个单电子。回答下列问题:
(1)基态E原子的价电子排布式为____________________
(2)A、B、C三种元素第一电离能由大到小的顺序为___________(用元素符号表示)。
(3)与A的单质分子互为等电子体的分子和离子分别是________(用分子和离子符号表示)。AB2的空间构型为___________,其中A原子的杂化类型是_______________
(4)B元素简单氢化物的沸点是同族元素中最高的,原因是_____________
(5)向含E元素的硫酸盐溶液中加入过量氨水,可得到深蓝色透明溶液。向溶液中加人乙醇,将析出深蓝色晶体。该晶体的化学式为[Cu(NH3)4]SO4H2O晶体中阳离子的结构式为____________
(6)C和D形成化合物的晶胞结构如图所示,已知晶体的密度为ρg/cm,阿伏加德罗常数为NA,则晶胞边长a=______________cm(用含ρ、NA的计算式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(分子式为H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中。下列有关判断不正确的是( )
A.45g草酸中含有1.204×1024个氧原子
B.1mol草酸中含有6.02×1023个分子
C.草酸的摩尔质量是90g/mol
D.1mol草酸在标准状况下的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6mol·L-1盐酸、6mol·L-1硫酸和蒸馏水)
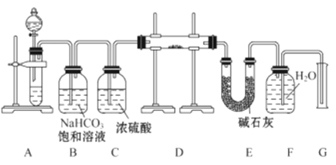
回答下列问题:
(1)装置A中液体试剂选用________
(2)装置B的作用是_________________,装置C的作用是_____________,装置E中碱石灰的作用是______________________________________________。
(3)装置D中发生反应的化学方程式是_________________________。
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的实验装置如图所示。下列关于实验操作或结论的叙述,不正确的( )
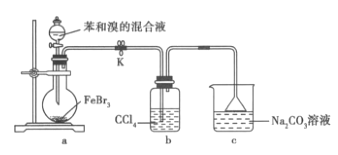
A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.实验中装置b 中的液体逐渐变为橙红色
C.若欲验证该反应为取代反应,可将c 中碳酸钠溶液更换为硝酸银溶液
D.反应结束后将a 中混合液直接倒入NaOH 溶液中,充分反应后分液并进行后续分离提纯操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某“导电分子线”的结构,下列对该有机分子的说法,正确的是( )
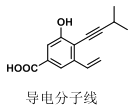
A.最多有 7 个原子共线
B.最多有 13 个碳原子共面
C.可发生加成、酯化、消去反应
D.不考虑立体异构,该分子中共有 7 种化学环境不同的氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如下实验。关于该实验分析不正确的是( )
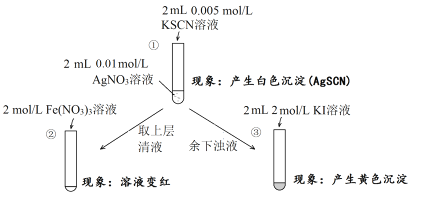
A.①浊液中存在平衡:AgSCN(s) ![]() Ag+(aq)+SCN-(aq)
Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g) + 3H2(g) ![]() 2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量a kJ |
② | 2 | 3 | 0 | 放出热量b kJ |
③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是
A. 放出热量关系:a < b <92.4
B. 三个容器内反应的平衡常数:③>①>②
C. 达平衡时氨气的体积分数:①>③
D. N2的转化率:②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,大气中氮氧化物和碳氢化合物受紫外线作用可产生二次污染物——光化学烟雾,其中某些反应过程如图所示。下列说法不正确的是

A. 整个过程中O3作催化剂
B. 反应III的方程式为O2+O===O3
C. 光化学烟雾中含甲醛、乙醛等刺激性物质
D. 反应I、反应Ⅱ均属于氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com