
【题目】现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6mol·L-1盐酸、6mol·L-1硫酸和蒸馏水)
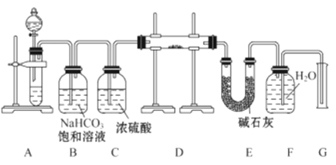
回答下列问题:
(1)装置A中液体试剂选用________
(2)装置B的作用是_________________,装置C的作用是_____________,装置E中碱石灰的作用是______________________________________________。
(3)装置D中发生反应的化学方程式是_________________________。
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为_____________________________________。
【答案】6mol·L-1盐酸 除去气体中的HCl 干燥气体 吸收装置D中反应剩余的CO2 2Na2O2+2CO2=2Na2CO3+O2、Na2O+CO2=Na2CO3 78%
【解析】
实验的目的是测定Na2O2试样的纯度,其中杂质为Na2O;根据所给装置,本实验中是要通过测定二氧化碳二氧化碳与Na2O2反应生成的氧气的量来确定样品中过氧化钠的量,所以首先在装置A中利用碳酸钙和盐酸反应生成二氧化碳,用饱和碳酸氢钠溶液除去CO2中混有的HCl气体,之后用浓硫酸进行干燥,然后在装置D中CO2和Na2O2反应生成氧气,用碱石灰吸收未反应的CO2,氧气不易溶于水,可以用排水法测定生成的氧气的体积。
(1)装置A的目的是制取二氧化碳,一般用盐酸和碳酸钙反应制取二氧化碳,所以装置A中液体试剂为盐酸;
(2)装置B可以除去CO2中混有的HCl气体;浓硫酸具有吸水性,所以装置C干燥气体;装置E中的碱石灰吸收未反应的CO2,避免对氧气体积的测定产生影响;
(3)装置D中为CO2和Na2O2、Na2O的反应,化学方程式为2Na2O2+2CO2=2Na2CO3+O2、Na2O+CO2=Na2CO3;
(4)生成的氧气体积为224mL,物质的量为![]() =0.01mol,根据反应方程式可知样品中Na2O2的物质的量为0.02mol,所以样品的纯度为
=0.01mol,根据反应方程式可知样品中Na2O2的物质的量为0.02mol,所以样品的纯度为![]() =78%。
=78%。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】你认为下列说法正确的是( )
A. 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
B. 氢键存在于分子之间,也存在于分子之内
C. 对于分子,其范德华力只随着相对分子质量的增大而增大
D. NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.实验室制备FeBr2实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将铁粉加热至600—700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始。不断将d中液溴滴入温度为100—120℃的D中。经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。

(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为_____________。C为________________。为防止污染空气,实验时应在F处连接盛___________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是____________________。
Ⅱ.探究FeBr2的还原性
(3)实验需要200 mL 0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是_____________,需称量FeBr2的质量为:_________。
(4)取10 mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br一被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+
设计实验证明假设2是正确的:________
(5)请用一个离子方程式来证明还原性Fe2+>Br一________:
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列粒子的空间构型
(1)CO2:_______________________
(2)H2S:____________
(3)SO2:___________
(4)NH4+:_________________
(5)CO32-:_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 高能原子轰击
高能原子轰击![]() 的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
A. 112号元素的相对原子质量为277
B. 此变化不属于化学变化
C. 科学家合成的112号元素是金属元素
D. 112号元素位于第七周期第ⅡB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ti、Fe、Cu、Ni为过渡金属元素,在工业生产中有重要的应用.
(1)①常温下Fe(CO)5呈液态,熔点为-20.5℃,沸点为103℃.据此可以判断其晶体为_________晶体,Fe(CO)5中铁的化合价为0,则该物质中含有的化学键类型有______(填字母).
A 离子键 B 极性共价键 C 非极性共价键 D 配位键
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________,配体H2O中O原子的杂化方式为________.
③NiO、FeO的晶体结构类型均与氧化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO_______FeO(填“<”或“>”).
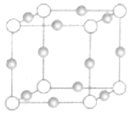
(2)Cu、N两元素形成某种化合物的晶胞结构如图(灰色球表示Cu原子),已知紧邻的白球与灰球之间的距离为acm,该晶胞的密度为________gcm-3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Kevlar(凯夫拉),原名聚对苯二甲酰对苯二胺,具有超高的机械性能,是制作防弹衣的原材料。Kevlar 的结构片段如右图所示,则下列说法不正确的是( )
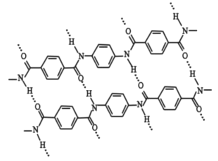
A.Kevlar 属于聚酰胺类合成高分子材料
B.图中虚线表示高分子链之间形成了类似肽链间的多重氢键,增强了材料的机械性能
C.Kevlar 可以发生完全水解,得到一种单体分子,该分子中既含有-COOH,又含有-NH2
D.Kevlar 高分子链的结构简式为 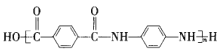
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行的实验,能达到相应实验目的的是()
A. 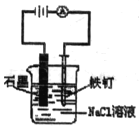 防止铁钉生锈
防止铁钉生锈
B. 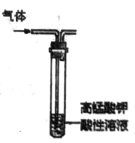 除去乙烷中混有的乙烯
除去乙烷中混有的乙烯
C. 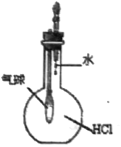 验证HCl气体在水中的溶解性
验证HCl气体在水中的溶解性
D. 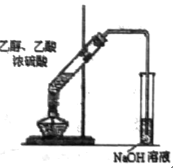 实验室制取乙酸乙酯
实验室制取乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com