
【题目】Kevlar(凯夫拉),原名聚对苯二甲酰对苯二胺,具有超高的机械性能,是制作防弹衣的原材料。Kevlar 的结构片段如右图所示,则下列说法不正确的是( )
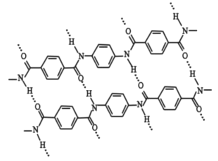
A.Kevlar 属于聚酰胺类合成高分子材料
B.图中虚线表示高分子链之间形成了类似肽链间的多重氢键,增强了材料的机械性能
C.Kevlar 可以发生完全水解,得到一种单体分子,该分子中既含有-COOH,又含有-NH2
D.Kevlar 高分子链的结构简式为 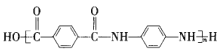
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】对于 A2+3B22C 的反应,以下化学反应速率的表示中,反应速率最快的是
A.υ(A2) = 0.4 mol·L-1·s-1B.υ(B2) = 0.8 mol·L-1·s-1
C.υ(C) = 0.6 mol·L-1·s-1D.υ(B2) = 4.2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用如图的实验装置测定Na2O2试样的纯度。(可供选用的反应物只有CaCO3固体、6mol·L-1盐酸、6mol·L-1硫酸和蒸馏水)
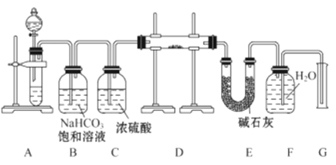
回答下列问题:
(1)装置A中液体试剂选用________
(2)装置B的作用是_________________,装置C的作用是_____________,装置E中碱石灰的作用是______________________________________________。
(3)装置D中发生反应的化学方程式是_________________________。
(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某“导电分子线”的结构,下列对该有机分子的说法,正确的是( )
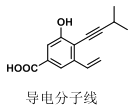
A.最多有 7 个原子共线
B.最多有 13 个碳原子共面
C.可发生加成、酯化、消去反应
D.不考虑立体异构,该分子中共有 7 种化学环境不同的氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如下实验。关于该实验分析不正确的是( )
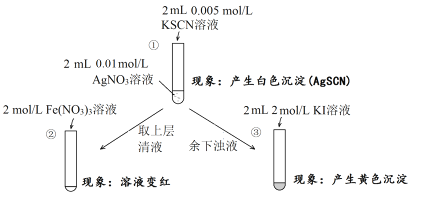
A.①浊液中存在平衡:AgSCN(s) ![]() Ag+(aq)+SCN-(aq)
Ag+(aq)+SCN-(aq)
B.②中颜色变化说明上层清液中含有SCN-
C.③中颜色变化说明有AgI生成
D.该实验可以证明AgI比AgSCN更难溶
查看答案和解析>>
科目:高中化学 来源: 题型:
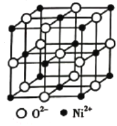
【题目】高氯酸三碳酰肼合镍{[Ni(CHZ)3](C104)2}是一种新型的起爆药。
(1)Ni2+某杰核外电子排布式为________。
(2)ClO4空间构型是_______;与ClO4互为等电子体的一种分子为_______(填化学式)。
(3)化学式中CHZ为碳酰肼,组成为CO(N2H3)2,碳酰肼中碳原子的杂化轨道类型为_____;C、N、0三种元素的电负性由大到小的顺序为______。
(4)高氯酸三碳酰肼合镍可由NiO、髙氯酸及碳酰肼化合而成。NiO的晶胞结构如图所示,晶胞中含有的Ni2+数目为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g) + 3H2(g) ![]() 2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=-92.4 kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量a kJ |
② | 2 | 3 | 0 | 放出热量b kJ |
③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是
A. 放出热量关系:a < b <92.4
B. 三个容器内反应的平衡常数:③>①>②
C. 达平衡时氨气的体积分数:①>③
D. N2的转化率:②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
| 选项 | a | b | c |
A | Al | AlCl3 | Al(OH)3 | |
B | CO2 | Na2CO3 | NaHCO3 | |
C | Si | SiO2 | H2SiO3 | |
D | S | SO3 | H2SO4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第四周期第VIA族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g)![]() 2Se(s)+2H2O(l) △H1=akJ/mol
2Se(s)+2H2O(l) △H1=akJ/mol
②2H2(g)+O2(g)![]() 2H2O(l) △H2=bkJ·mol-1
2H2O(l) △H2=bkJ·mol-1
则反应 H2(g)+Se(s)![]() H2Se(g) △H3=___________kJ/mol(用含a、b 的代数式表不)。
H2Se(g) △H3=___________kJ/mol(用含a、b 的代数式表不)。
(2)T℃时,向一恒容密闭容器中加入3molH2和lmolSe,发生反应H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①下列情况可判断反应达到平衡状态的是__________(填字母代号)。
a.气体的密度不变 b.v(H2)= v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡淮合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的 H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提髙,请用化学平衡理论解释:_____________________________________________。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图所示:
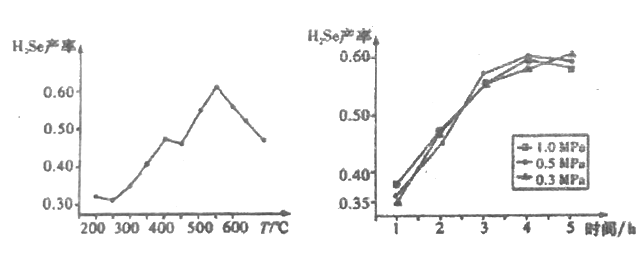
则制备H2Se的最佳溫度和压强为______________________________。
(3)工业上从含硒废料中提取硒的方法是用硫酸和硝酸钠的混合溶液处理后获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸,硒酸与盐酸反应的化学方程式为_________,最后通入SO2析出硒单质。
(4)已知常温下H2Se的电离平衡常数K1=1.3×10-4,K2=5.0×10-11,则NaHSe溶液呈__________(填“酸性”或“碱性”),请通过计算数据说明___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com