
【题目】对于 A2+3B22C 的反应,以下化学反应速率的表示中,反应速率最快的是
A.υ(A2) = 0.4 mol·L-1·s-1B.υ(B2) = 0.8 mol·L-1·s-1
C.υ(C) = 0.6 mol·L-1·s-1D.υ(B2) = 4.2 mol·L-1·min-1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量。
(1)写出该反应的热化学方程式_________。
(2)若1g水蒸气转化成液态水放热2.494kJ,则反应H2(g)+![]() O2(g)=H2O(l)的ΔH=_____kJ/mol。
O2(g)=H2O(l)的ΔH=_____kJ/mol。
(3)HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和NaOH反应的中和热的热化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示一些晶体中的某些结构,请回答下列问题:
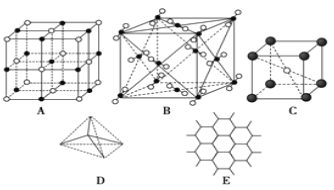
(1)代表金刚石的是(填编号字母,下同)_____,其中每个碳原子与_____个碳原子最近且距离相等。
(2)代表石墨的是_____,每个正六边形占有的碳原子数平均为_____个。
(3)代表 NaCl 的是_________,每个Na+周围与它最近且距离相等的Cl-有_____个。
(4)代表 CsCl 的是_____,每个Cs+与_____个Cl-紧邻。
(5)代表干冰的是_____,每个 CO2 分子与_____个 CO2 分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种剧毒气体,如图为质子膜H2S燃料电池的示意图,可对H2S废气资源化利用。下列叙述错误的是
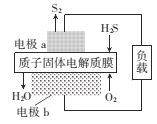
![]()
A. a是负极,电池工作时,电子的流动力向是:电极a-负载一电极b-质子膜一电极a
B. 电池工作时,化学能转化为电能和热能
C. 电极b上发生的电极反应式为O2+ 4e-+4H+=2H2O
D. 当电路中通过4mol电子时,有4molH+经质子膜进入正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是

A. ①②中Mg作负极、③④中Fe作负极
B. ②中A1作负极,电极反应式为2A1-6e-=2Al3+
C. ③中Fe作负极,电极反应式为Fe-2e-=Fe2+
D. ④中Cu作正极,电极反应式为O2+4e-+2H2O=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】你认为下列说法正确的是( )
A. 液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
B. 氢键存在于分子之间,也存在于分子之内
C. 对于分子,其范德华力只随着相对分子质量的增大而增大
D. NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
I.实验室制备FeBr2实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管,e是两个耐高温的瓷皿,其中盛有细铁粉。
实验开始时,先将铁粉加热至600—700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始。不断将d中液溴滴入温度为100—120℃的D中。经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁。

(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸。为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为_____________。C为________________。为防止污染空气,实验时应在F处连接盛___________的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是____________________。
Ⅱ.探究FeBr2的还原性
(3)实验需要200 mL 0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是_____________,需称量FeBr2的质量为:_________。
(4)取10 mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br一被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+
设计实验证明假设2是正确的:________
(5)请用一个离子方程式来证明还原性Fe2+>Br一________:
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Kevlar(凯夫拉),原名聚对苯二甲酰对苯二胺,具有超高的机械性能,是制作防弹衣的原材料。Kevlar 的结构片段如右图所示,则下列说法不正确的是( )
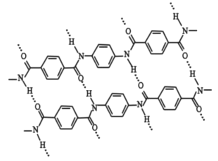
A.Kevlar 属于聚酰胺类合成高分子材料
B.图中虚线表示高分子链之间形成了类似肽链间的多重氢键,增强了材料的机械性能
C.Kevlar 可以发生完全水解,得到一种单体分子,该分子中既含有-COOH,又含有-NH2
D.Kevlar 高分子链的结构简式为 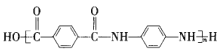
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com