
【题目】已知由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量。
(1)写出该反应的热化学方程式_________。
(2)若1g水蒸气转化成液态水放热2.494kJ,则反应H2(g)+![]() O2(g)=H2O(l)的ΔH=_____kJ/mol。
O2(g)=H2O(l)的ΔH=_____kJ/mol。
(3)HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和NaOH反应的中和热的热化学方程式为_________。
【答案】H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol [或2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol] -286.7
O2(g)=H2O(g) ΔH=-241.8 kJ/mol [或2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol] -286.7 ![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
【解析】
(1)物质燃烧放出的热量与反应物的多少呈正比,先写出氢气燃烧产生气态水的化学方程式,然后根据方程式中氢气的物质的量确定反应放出热量的多少,并注明物质的聚集状态,就得到相应的热化学方程式;
(2)先计算热化学方程式中水蒸气的物质的量的多少,用相应的水的质量乘以1g水蒸气转化为液态水放出的热量就是气态水转化为液态水再放出的热量,据此分析生成液态水的ΔH;
(3)根据中和热是酸、碱的稀溶液发生中和反应产生1mol液态水和可溶性盐时放出的热量计算。
(1)氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量,则氢气燃烧产生水蒸气的化学方程式为H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol,若表示为整数系数,由于物质燃烧放出的热量与物质的量的多少呈正比,因此也可表示为:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol;
O2(g)=H2O(g) ΔH=-241.8 kJ/mol,若表示为整数系数,由于物质燃烧放出的热量与物质的量的多少呈正比,因此也可表示为:2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol;
(2)根据热化学方程式H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol可知:反应会产生1mol水,其质量是18g,根据1g水蒸气转化成液态水放热2.494kJ,则反应产生18g液态水时会再放出的热量为2.494kJ/g×18g=44.89kJ,因此1mol氢气完全燃烧生成液态水的热化学方程式为H2(g)+
O2(g)=H2O(g) ΔH=-241.8 kJ/mol可知:反应会产生1mol水,其质量是18g,根据1g水蒸气转化成液态水放热2.494kJ,则反应产生18g液态水时会再放出的热量为2.494kJ/g×18g=44.89kJ,因此1mol氢气完全燃烧生成液态水的热化学方程式为H2(g)+![]() O2(g)=H2O(l) ΔH=-(241.8+44.9) kJ/mol =-286.7kJ/mol;
O2(g)=H2O(l) ΔH=-(241.8+44.9) kJ/mol =-286.7kJ/mol;
(3)HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,H2SO4和NaOH反应产生硫酸钠和水,该反应的中和热是反应产生1mol液态水放出的热量为57.3kJ,所以该反应的中和热的热化学方程式为![]() H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=![]() Na2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol。
Na2SO4(aq)+H2O(l) ΔH=-57.3kJ/mol。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
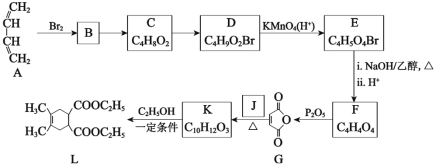
【题目】合成药物中间体L的路线如图(部分反应条件或试剂略去):
已知:I.最简单的Diels-Alder反应是![]()
II.![]()
III.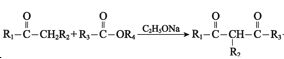 +R4OH
+R4OH
请回答下列问题:
(1)下列说法中正确的是____。
A.B→C的反应条件可以是“NaOH/H2O,△”
B.C→D的目的是实现基团保护,防止被KMnO4(H+)氧化
C.欲检验化合物E中的溴元素,可向其中滴加HNO3酸化的AgNO3溶液观察是否有淡黄色沉淀生成
D.合成药物中间体L的分子式是C14H20O4
(2)写出化合物J的结构简式____。
(3)写出K→L的化学方程式____。
(4)设计由L制备M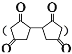 的合成路线(用流程图表示,试剂任选)____。
的合成路线(用流程图表示,试剂任选)____。
(5)写出化合物K同时符合下列条件的同分异构体的结构简式____。
①1H-NMR谱检测表明:分子中共有5种化学环境不同的氢原子;
②能发生水解反应;
③遇FeCl3溶液发生显色反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可用于合成除草剂和杀虫剂。一定条件下,恒容密闭容器中,发生反应H2S(g)+CO2(g) ![]() COS(g)+H2O(g),能充分说明该反应已经达到化学平衡状态的是
COS(g)+H2O(g),能充分说明该反应已经达到化学平衡状态的是
A. 正、逆反应速率都等于零
B. H2S、CO2、COS、H2O的浓度相等
C. H2S、 CO2、COS、H2O的浓度不再变化
D. H2S、CO2、COS、H2O在密闭容器中共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
A.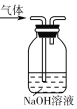 用装置除去乙烯中的少量酸性气体
用装置除去乙烯中的少量酸性气体
B.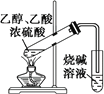 用装置完成实验室制取乙酸乙酯
用装置完成实验室制取乙酸乙酯
C. 用装置证明温度对化学平衡的影响
用装置证明温度对化学平衡的影响
D.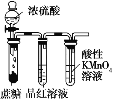 用装置验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、还原性
用装置验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在容积为2 L的密闭容器中,A、B的物质的量随时间变化的曲线如图所示,请据图回答下列问题:
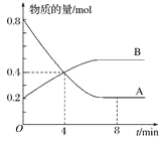
(1)该反应的化学方程式为_______________。
(2)在4 min末时,A、B的物质的量浓度c(A)________c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A)________Δc(B)(以上填“>”、“<”或“=”)。
(3)反应开始至4 min时,A的平均反应速率为_______________________。
(4)4 min时,反应是否达到平衡状态?________(填“是”或“否”)。8 min时,υ(正)________(填“>”、“<”或“=”)υ(逆)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同金属在其不同浓度盐溶液中可形成浓差电池。如下图所示装置是利用浓差电池电解Na2SO4溶液(a、b电极均为石墨电极),可以制得O2、H2、H2SO4和NaOH。下列说法不正确的是
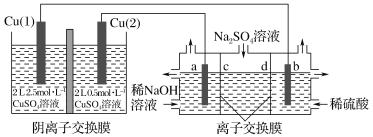
A.a电极的电极反应为4H2O+4e-=2H2↑+4OH-
B.c、d离子交换膜依次为阳离子交换膜和阴离子交换膜
C.电池放电过程中,Cu(1)电极上的电极反应为Cu2++2e-=Cu
D.电池从开始工作到停止放电,电解池理论上可制得320gNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1 mol X和2 mol Y,发生反应:X(g)+2Y(g)![]() M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
M(g) ΔH=-a kJ/mol(a>0),5 min末测得M的物质的量为0.4 mol。则下列说法正确的是
A. 0~5 min,Y的平均反应速率为0.08 mol·L-1·min-1
B. 当容器中混合气体密度不变时达到平衡状态
C. 平衡后升高温度,X的反应速率降低
D. 到达平衡状态时,反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 电极A上H2和CO都发生了氧化反应
B. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol电子
3H2+CO,每消耗1molCH4转移12mol电子
C. 电池工作时,电能转变为化学能
D. 电极B上发生的电极反应为:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于 A2+3B22C 的反应,以下化学反应速率的表示中,反应速率最快的是
A.υ(A2) = 0.4 mol·L-1·s-1B.υ(B2) = 0.8 mol·L-1·s-1
C.υ(C) = 0.6 mol·L-1·s-1D.υ(B2) = 4.2 mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com