
【题目】下图表示一些晶体中的某些结构,请回答下列问题:
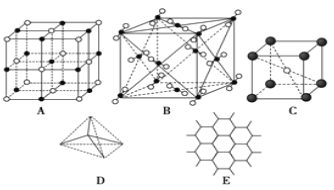
(1)代表金刚石的是(填编号字母,下同)_____,其中每个碳原子与_____个碳原子最近且距离相等。
(2)代表石墨的是_____,每个正六边形占有的碳原子数平均为_____个。
(3)代表 NaCl 的是_________,每个Na+周围与它最近且距离相等的Cl-有_____个。
(4)代表 CsCl 的是_____,每个Cs+与_____个Cl-紧邻。
(5)代表干冰的是_____,每个 CO2 分子与_____个 CO2 分子紧邻。
(6)已知石墨中碳碳键的键长比金刚石中碳碳键的键长短,则上述五种物质熔点由高到低的排列顺序为_____。
【答案】D 4 E 2 A 6 C 8 B 12 石墨>金刚石>NaCl>CsCl>干冰
【解析】
先根据不同晶体的结构特点确定图形所代表的物质。金刚石的基本单元是正四面体,为空间网状结构,石墨是层状结构,NaCl晶胞是简单的立方晶胞,氯离子的配位数是6,氯化铯的配位数是8,干冰是分子晶体,各种物质的熔点关系为原子晶体>离子晶体>分子晶体,利用均摊法可以进行晶胞的计算。
(1)金刚石是空间网状结构,每个碳原子连接4个碳原子,形成四面体单元结构,原子间以共价键相结合,属于原子晶体,故选D;
(2)石墨是层状结构,其晶体中碳原子呈平面正六边形排列,每个正六边形占有的碳原子数平均=1×1/3×6=2,故选E;
(3)NaCl是离子晶体,其构成微粒是阴阳离子,NaCl晶胞是简单的立方单元,阴阳离子间通过离子键结合,氯离子和钠离子的配位数都是6,每个钠离子周围有6个氯离子,故选A;
(4)CsCl是由阴阳离子构成的,氯离子和铯离子的配位数是8,故选C;
(5)干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,所以图B为干冰晶体,故选B;
(6)晶体熔沸点:原子晶体>离子晶体>分子晶体,离子晶体熔沸点与离子半径成正比,与电荷成正比,金刚石是原子晶体、NaCl和CsCl是离子晶体、干冰是分子晶体、石墨是混合型晶体,根据配位数及晶胞结构知,A、B、C、D、E分别是NaCl、干冰、CsCl、金刚石、石墨,钠离子半径小于铯离子半径,石墨中C-C键长小于金刚石中C-C键长,所以这几种晶体熔点高低顺序是E>D>A>C>B,即:石墨>金刚石>NaCl>CsCl>干冰。


科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
A.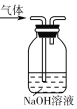 用装置除去乙烯中的少量酸性气体
用装置除去乙烯中的少量酸性气体
B.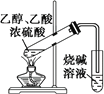 用装置完成实验室制取乙酸乙酯
用装置完成实验室制取乙酸乙酯
C. 用装置证明温度对化学平衡的影响
用装置证明温度对化学平衡的影响
D.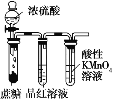 用装置验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、还原性
用装置验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 电极A上H2和CO都发生了氧化反应
B. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol电子
3H2+CO,每消耗1molCH4转移12mol电子
C. 电池工作时,电能转变为化学能
D. 电极B上发生的电极反应为:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是
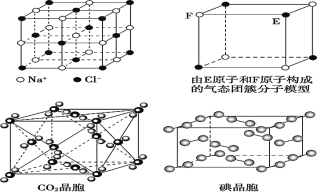
A. 在 NaCl 晶体中,Na+或 Cl-的配位数都是 6
B. 该气态团簇分子的分子式为 EF 或 FE
C. 在 CO2 晶体中,一个晶胞实际含有 4 个 CO2 分子
D. 在碘晶体中,碘分子的排列有两种不同的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C、D、E的原子序数依次增大,且均小于36。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;D的价电子数为2且与E同周期;E的基态原子的内部各能层均排满,且4s能级有1个单电子。回答下列问题:
(1)基态E原子的价电子排布式为____________________
(2)A、B、C三种元素第一电离能由大到小的顺序为___________(用元素符号表示)。
(3)与A的单质分子互为等电子体的分子和离子分别是________(用分子和离子符号表示)。AB2的空间构型为___________,其中A原子的杂化类型是_______________
(4)B元素简单氢化物的沸点是同族元素中最高的,原因是_____________
(5)向含E元素的硫酸盐溶液中加入过量氨水,可得到深蓝色透明溶液。向溶液中加人乙醇,将析出深蓝色晶体。该晶体的化学式为[Cu(NH3)4]SO4H2O晶体中阳离子的结构式为____________
(6)C和D形成化合物的晶胞结构如图所示,已知晶体的密度为ρg/cm,阿伏加德罗常数为NA,则晶胞边长a=______________cm(用含ρ、NA的计算式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
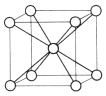
【题目】周期表前四周期的元素 a、b、c、d、e,原子序数依次增大。a 的核外电子总数与其周期数相同,b 的价电子层中的未成对电子有 3 个,c 的最外层电子数为其内层电子数的 3 倍,d 与 c 同族;e 的基态原子的价电子数是其 N 层电子数的4 倍。回答下列问题:
(1)a 的基态原子核外电子运动的轨道呈_____形。
(2)b 的基态原子的核外电子占据_____个原子轨道。
(3)c 的价电子轨道表示式为_____。
(4)b 与 c 的第一电离能相比,较大的是_________(填元素符号),理由是_____。
(5)e 的晶体在一定温度下的晶胞结构如图,其一个晶胞的质量为_________g(用含 NA 的式子表示),晶体中空间利用率为_______(用 含 π 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于 A2+3B22C 的反应,以下化学反应速率的表示中,反应速率最快的是
A.υ(A2) = 0.4 mol·L-1·s-1B.υ(B2) = 0.8 mol·L-1·s-1
C.υ(C) = 0.6 mol·L-1·s-1D.υ(B2) = 4.2 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.01mol/LNaAc溶液的pH,溶液中HAc、Ac-、H+、OH-浓度的对数值lgc与溶液pH的变化关系如图所示。若pKa=-lgKa,下列叙述错误的是

A. 直线b、d分别对应H+、OH-
B. pH=6时,c(HAc)>c(Ac-)>c(H+)
C. HAc电离常数的数量级为10-5
D. 从曲线a与c的交点可知pKa=pH=4.74
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某“导电分子线”的结构,下列对该有机分子的说法,正确的是( )
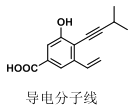
A.最多有 7 个原子共线
B.最多有 13 个碳原子共面
C.可发生加成、酯化、消去反应
D.不考虑立体异构,该分子中共有 7 种化学环境不同的氢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com