
【题目】处理烟气中的![]() 可以采用碱吸——电解法,其流程如左图:模拟过程Ⅱ如图,下列推断正确的是( )
可以采用碱吸——电解法,其流程如左图:模拟过程Ⅱ如图,下列推断正确的是( )
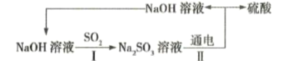
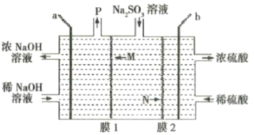
A.膜1为阴离子交换膜,膜2为阳离子交换膜
B.若用锌锰碱性电池为电源,a极与锌极相连
C.a极的电极反应式为![]()
D.若收集![]() 的P(标准状况下),则转移
的P(标准状况下),则转移![]() 电子
电子
【答案】B
【解析】
由流程图可知,碱吸-电解法处理SO2,最终将SO2转变成硫酸,同时也使碱液再生,重复利用;电解时,S发生变价由亚硫酸根转变为硫酸根;因此,电解池中生成硫酸的极室中发生的是亚硫酸根被氧化的反应,所以b电极为阳极,a电极则为阴极;进一步可知,膜1即阳离子交换膜,允许亚硫酸钠溶液中的Na+转移至阴极区;膜2为阴离子交换膜,允许亚硫酸钠溶液中的亚硫酸根转移至阳极区。
A.通过分析可知,膜1为阳离子交换膜,膜2为阴离子交换膜,A项错误;
B.通过分析可知,电解池中a电极为阴极,应该与外电源的负极相接,而锌锰碱性电池中锌电极为负极,B项正确;
C.通过分析可知,a电极为阴极,发生的是还原反应,电极反应式为:![]() ,C项错误;
,C项错误;
D.通过分析可知,P即为氢气,若要收集标况下22.4L的氢气,则需要转移2mol电子,D项错误;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学将铁片A和碳棒B用导线连接后放入食盐水中模拟菜刀生锈过程,则下列叙述错误的是( )

A. 导线中有电子流动,电流方向为A流向B
B. 溶液中的O2在电极B得电子,电极B附近碱性增强
C. 电极A上的电极反应式为Fe-2e-=Fe2+
D. 溶液中的Na+向电极B附近移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为 NaCl 晶胞结构示意图(晶胞边长为 a nm)。
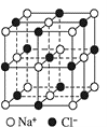

(1)能准确证明其是晶体的方法是_____
(2)晶体中,Na+位于Cl-所围成的正_____面体的体心, 该多面体的边长是_____nm。
(3)晶体中,在每个Na+的周围与它最近且等距离的 Na+共有_____个。
(4)Na+半径与 Cl-半径的比值是_________(保留小数点后三位, ![]() =1.414。
=1.414。
(5)在 1413℃时,NaCl 晶体转变成氯化钠气体。现有 5.85 g NaCl 晶体,使其汽化,测得气体体积为 1.12 L(已换算为标准状况)。则此时氯化钠气体的分子________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含锰废料(主要成分为MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如图所示:
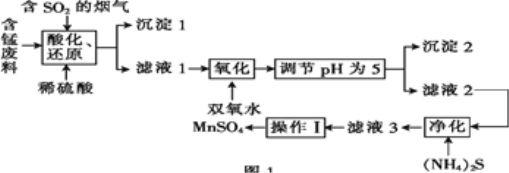
已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.3×10-33 | 4.0×10-38 | 2.2×10-20 | 1.9×10-14 |
回答下列问题:
(1)沉淀1的化学式为____。
(2)室温下,调节pH为5。试通过计算说明此时Al3+、Fe3+已沉淀完全:____。
(3)(NH4)2S的电子式为____;“净化”时,加入(NH4)2S的作用为____。
(4)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为____。
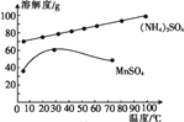
(5)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如图所示。据此判断,“操作Ⅰ”应为蒸发浓缩、____、洗涤、干燥。
(6)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用废铁屑制备磁性胶体粒子,制取过程如下:

下列说法不正确的是
A. 用Na2CO3溶液浸泡是为了除去废铁屑表面的油污
B. 通入N2是防止空气中的O2氧化二价铁元素
C. 加适量的H2O2是为了将部分Fe2+氧化为Fe3+,涉及反应:H2O2+2Fe2++2H+=2Fe3++2 H2O
D. 溶液A中Fe2+和Fe3+的浓度比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(分子式为H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中。下列有关判断不正确的是( )
A.45g草酸中含有1.204×1024个氧原子
B.1mol草酸中含有6.02×1023个分子
C.草酸的摩尔质量是90g/mol
D.1mol草酸在标准状况下的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016 年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:
(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB 族元素对应离子的萃取,如La3+、Sc2+。写出基态二价 钪离子(Sc2+)的核外电子排布式:____,其中电子占据的轨道数为_____个。
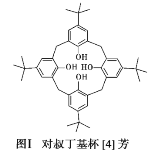
(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为_____,羟基间的相互作用力为_____。
(3)不同大小苯芳烃能识别某些离子,如:N3-、SCN等。一定条件下,SCN与 MnO2反应可得到(SCN)2,试写出(SCN)2的结构式_______。
(4)NH3分子在独立存在时 H-N-H 键角为 106.7°。 [Zn(NH3)6]2+离子中 H-N-H 键角变为 109.5°,其原因是:_________________________。
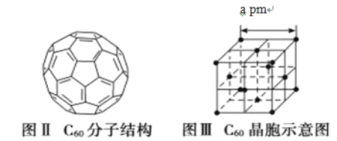
(5)已知 C60 分子结构和 C60 晶胞示意图(如图Ⅱ、图Ⅲ所示):则一个 C60 分子中含有σ键的个数为______,C60 晶体密度的计算式为____gcm3。(NA 为阿伏伽德罗常数 的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备溴苯的实验装置如图所示。下列关于实验操作或结论的叙述,不正确的( )
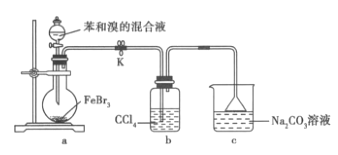
A.向圆底烧瓶中滴加苯和溴的混合液前需先打开K
B.实验中装置b 中的液体逐渐变为橙红色
C.若欲验证该反应为取代反应,可将c 中碳酸钠溶液更换为硝酸银溶液
D.反应结束后将a 中混合液直接倒入NaOH 溶液中,充分反应后分液并进行后续分离提纯操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )
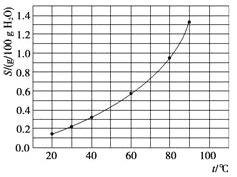
A. 溴酸银的溶解时放热过程
B. 温度升高时溴酸银溶解速度加快
C. 60 ℃时溴酸银的Ksp约等于6×10-4
D. 若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com