
【题目】《斯德哥尔摩公约》禁用的12种持久性有机污染物之一是滴滴涕,其结构简式为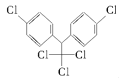 ,有关滴滴涕的说法正确的是( )
,有关滴滴涕的说法正确的是( )
A.它属于芳香烃B.分子中最多有23个原子共面
C.分子式为C14H8Cl5D.该物质不能和NaOH溶液反应
【答案】B
【解析】
A. 根据物质分子结构可知:该物质分子中含有苯环,且含有C、H、Cl三种元素,因此属于芳香烃的衍生物,A错误;
B. 苯分子是平面结构,Cl原子取代苯分子中H原子的位置,在苯分子的平面上;与两个苯环连接的C原子在两个苯环的平面上,两个平面共直线,可能在同一平面上;分子中含有的饱和C原子为四面体结构,由于通过该C原子的平面最多可通过2个顶点,若与之连接的2个苯环上C原子在该平面上,则另一个CCl3上的C原子一定不在该平面上,所以共平面的原子数目为11+11+1=23个,B正确;
C. 根据物质分子结构简式可知其分子式为C14H9Cl5,C错误;
D. 该物质属于卤代烃,能够与NaOH水溶液在加热时发生取代反应,D错误;
故合理选项是B。


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法中正确的是
A. 4g甲烷完全燃烧转移的电子数为2NA
B. 11.2L(标准状况)CCl4中含有的共价键数为2NA
C. 3 mol SO2和1mol O2于密闭容器中催化反应后分子总数为3NA
D. 1L 0.1mol·L-1的Na2S溶液中HS-和S2-离子数之和为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲烷与氯气在光照条件下反应,不涉及的实验现象是( )
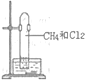
A.气体的黄绿色变浅至消失B.试管内壁上有油珠附着
C.试管内水面上升D.试管内有白烟生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )
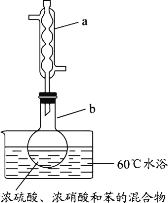
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应先向浓硝酸中缓缓加入浓硫酸,待冷却至室温后,再将苯逐滴滴入
C.仪器a的作用是冷凝回流,提高原料的利用率
D.反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多相催化反应是在催化剂表面通过吸附、解吸过程进行的。如图,我国学者发现T°C时,甲醇(CH3OH)在铜基催化剂上的反应机理如下:
反应I: CH3OH(g)=CO(g)+2H2 (g) H1=akJ/mol
反应Ⅱ: CO(g)+H2O(g)=CO2 (g)+H2 (g) H2=-bkJ/mol (b>0)
总反应: CH3OH(g)+H2O(g)=CO2 (g)+3H2(g)H3= ckJ/mol

下列有关说法中正确的是( )
A.反应I是放热反应
B.1mol CH3OH(g)和H2O(g)的总能量大于1mol CO2(g)和3mol H2(g)的总能量
C.c>0
D.优良的催化剂降低了反应的活化能,并减少H3,节约了能源。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法不正确的是( )

A.元素甲的原子结构示意图为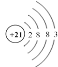
B.原子半径比较:甲>乙>Si
C.元素乙的简单气态氢化物的稳定性比CH4弱
D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
A.2分钟反应放出的热量值小于0.1akJ
B.用氧气表示0~2min的反应速率:v(O2)=0.05mol·L-1·min-1
C.2分钟内NH3的转化率是50%
D.2分钟末c(H2O)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(HF)2(g)![]() 2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
2HF(g) △H>0,平衡体系的总质量m(总)与总物质的量n(总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是
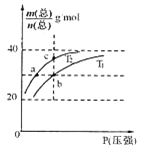
A.温度:T1< T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:v(b)>v(a)
D.当![]() 30g·mol-1时,n(HF):n[(HF)2]=2:1
30g·mol-1时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com