
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法不正确的是( )

A.元素甲的原子结构示意图为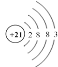
B.原子半径比较:甲>乙>Si
C.元素乙的简单气态氢化物的稳定性比CH4弱
D.推测乙可以用作半导体材料
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
【题目】温室气体CO2资源化利用的一种途径如下,生成物H和I可用作锂离子电池的电解质。
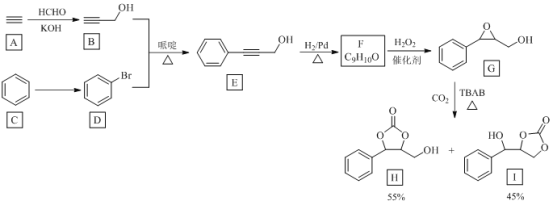
回答下列问题:
(1)由A到B的反应类型为________。
(2)由C到D反应所需试剂为________。
(3)E中官能团的名称是________。
(4)F合成G的反应方程式为________。
(5)H的分子式为________。
(6)写出与G互为同分异构体的羧酸类芳香化合物的结构简式(核磁共振氢谱为四组峰,峰面积比为6:2:1:1)________。
(7)设计由丙炔和甲醛为起始原料制备 和
和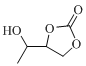 的合成路线 ____(无机试剂任选)。
的合成路线 ____(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题。
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]() ⑥
⑥![]() ⑦
⑦![]() ⑧
⑧![]()
(1)只含有离子键的是______(填序号,下同)。
(2)含有共价键的离子化合物是_______。
(3)属于共价化合物的是_______。
(4)熔融状态下和固态时都能导电的物质是_______。
(5)用电子式表示![]() 的形成过程_______。
的形成过程_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用Na2SO3固体与浓硫酸反应制取SO2,用如图所示装置完成SO2性质性质的探究,请按要求完成填空:
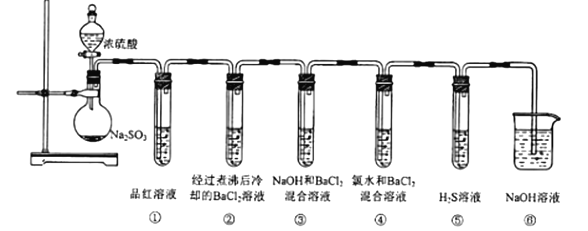
(1)实验中试管①中品红溶液褪色,实验结束后将试管①取下,置于沸水浴中加热,可观察到的实验现象为__。
(2)试管②中无明显现象,而试管③中出现白色沉淀,该沉淀的化学式为___。
(3)试管④中产生白色沉淀,写出其中发生反应的离子方程式:__和___。
(4)试管⑤中出现淡黄色沉淀,证明SO2具有__性。
(5)试管⑥的作用为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《斯德哥尔摩公约》禁用的12种持久性有机污染物之一是滴滴涕,其结构简式为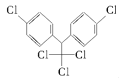 ,有关滴滴涕的说法正确的是( )
,有关滴滴涕的说法正确的是( )
A.它属于芳香烃B.分子中最多有23个原子共面
C.分子式为C14H8Cl5D.该物质不能和NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组成一套制备、净化乙炔的装置,并可通过测定乙炔的量,从而计算电石纯度。
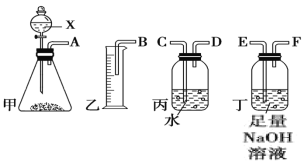
(1)实验室制乙炔的化学反应方程式_____________________________;
(2)进行实验时,所制气体从左向右流,仪器的正确连接顺序是____________(填接口字母);
(3)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用________________;
(4)装置丁的作用是____________________
(5)如果乙中收集到水的体积为V mL,电石质量为m g,则电石的纯度为_____________。(体积已换算成标准状况下体积)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N | C—H |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 | 414 |
则该反应的ΔH=_________kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH <0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
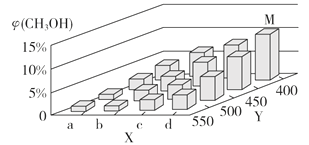
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_________。
②X轴上a点的数值比b点_________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是________________________________。
(3)工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
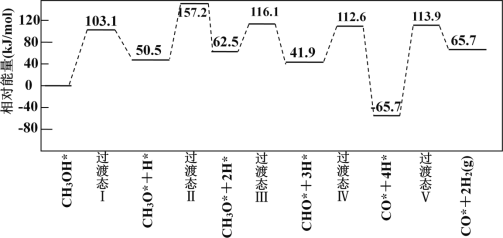
该历程中,放热最多的步骤的化学方程式为______________________________________________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在20世纪90年代末,科学家发现碳有新的单质形态![]() 存在。后来人们又相继得到了
存在。后来人们又相继得到了![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是
等另外一些球碳分子。21世纪初,科学家又发现了管状碳分子和洋葱状碳分子,大大丰富了碳元素单质的家族。下列有关碳元素单质的说法错误的是
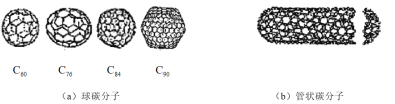
A.金刚石和石墨的熔点肯定比![]() 高
高
B.熔点:![]()
C.球碳分子、管状碳分子和洋葱状碳分子都是分子晶体,都是碳的同素异形体
D.金刚石以非分子形式的粒子存在,属于原子晶体;![]() 、
、![]() 、管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质不互为同素异形体
、管状碳分子和洋葱状碳分子以分子形式的粒子存在,属于分子晶体;这些碳单质不互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下,发生化学反应H2(g)+I2(g)![]() 2HI(g),下列选项中不能作为达到平衡的标志的是( )
2HI(g),下列选项中不能作为达到平衡的标志的是( )
A. 混合气体颜色不再变化
B. 单位时间内生成nmol氢气的同时生成nmol碘蒸气
C. 若该反应在隔热密闭体积恒定的容器中进行反应,体系的温度不再变化
D. 2v(H2)正=v(HI)逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com