
【题目】实验室可用Na2SO3固体与浓硫酸反应制取SO2,用如图所示装置完成SO2性质性质的探究,请按要求完成填空:
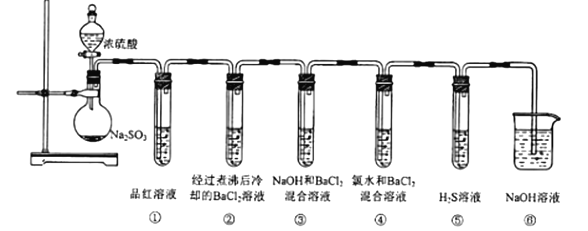
(1)实验中试管①中品红溶液褪色,实验结束后将试管①取下,置于沸水浴中加热,可观察到的实验现象为__。
(2)试管②中无明显现象,而试管③中出现白色沉淀,该沉淀的化学式为___。
(3)试管④中产生白色沉淀,写出其中发生反应的离子方程式:__和___。
(4)试管⑤中出现淡黄色沉淀,证明SO2具有__性。
(5)试管⑥的作用为__。
【答案】溶液恢复成原来的红色 BaSO3 SO2 +Cl2 +2H2O=4H++SO42-+2Cl- SO42-+Ba2+=BaSO4↓ 氧化 吸收多余的SO2,防止污染环境
【解析】
浓硫酸和Na2SO3反应生成SO2,SO2使品红溶液褪色,验证漂白性,SO2不和BaCl2反应,但有NaOH存在时会反应生成BaSO3沉淀,氯水和SO2反应生成H2SO4和HCl,H2SO4和BaCl2反应生成BaSO4沉淀,SO2与H2S反应生成S单质,体现SO2的氧化性,最后NaOH与SO2反应处理尾气。
⑴实验中试管①中品红溶液褪色,实验结束后将试管①取下,置于沸水浴中加热,可观察到的实验现象为溶液恢复成原来的红色;
⑵试管②中无明显现象,而试管③中出现白色沉淀,是由于SO2和NaOH反应生成Na2SO3,Na2SO3和BaCl2反应生成BaSO3和NaCl,因此该沉淀的化学式为BaSO3;
⑶试管④中产生白色沉淀,是由于SO2和氯水中氯气反应生成H2SO4和HCl,H2SO4和BaCl2反应生成BaSO4和HCl,发生反应的离子方程式:SO2+Cl2+2H2O=4H++SO42-+2Cl-和SO42-+Ba2+=BaSO4↓;
⑷试管⑤中出现淡黄色沉淀,说明SO2化合价降低,证明SO2具有氧化性;
⑸试管⑥的作用为吸收多余的SO2,防止污染环境。


科目:高中化学 来源: 题型:
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是_______(用对应的元素符号表示);基态D原子的电子排布式为______。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取_____杂化;BC3-的立体构型为______(用文字描述)。
(3)1mol AB-中含有的π键个数为______。
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比______。
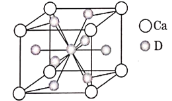
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。己知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
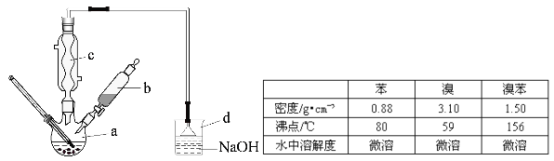
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 ③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。
A.25mL B. 50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是白色砂状或淡黄色粉末状固体,易溶于水、不溶于醇,该物质具有强还原性,在空气中易被氧化为NaHSO4,75℃以上会分解产生SO2。是重要的有机合成原料和漂白剂。
制取Na2S2O4常用甲酸钠法:控制温度60~70℃,在甲酸钠(HCOONa)的甲醇溶液中,边搅拌边滴加Na2CO3甲醇溶液,同时通入SO2,即可生成Na2S2O4。反应原理如下:2HCOONa+4SO2+Na2CO3=2Na2S2O4+H2O+3CO2
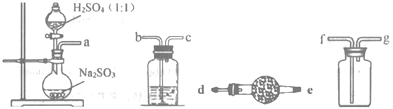
(1)如图,要制备并收集干燥纯净的SO2气体,接口连接的顺序为:a接__,__接__,__接__。制备SO2的化学方程式为___。
(2)实验室用图装置制备Na2S2O4。

①Na2S2O4中硫元素的化合价为___。
②仪器A的名称是___。
③水浴加热前要通一段时间N2,目的是___。
④为得到较纯的连二亚硫酸钠,需要对在过滤时得到的连二亚硫酸纳进行洗涤,洗涤的方法是___。
⑤若实验中所用Na2SO3的质量为6.3g,充分反应后,最终得到mg纯净的连二亚硫酸钠,则连二亚硫酸钠的产率为___(用含m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )
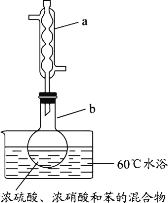
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应先向浓硝酸中缓缓加入浓硫酸,待冷却至室温后,再将苯逐滴滴入
C.仪器a的作用是冷凝回流,提高原料的利用率
D.反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数(25 ℃) | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法不正确的是( )

A.元素甲的原子结构示意图为
B.原子半径比较:甲>乙>Si
C.元素乙的简单气态氢化物的稳定性比CH4弱
D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“![]() ”或“
”或“![]() ”回答下列问题。
”回答下列问题。
(1)酸性:H2CO3 ______H2SiO3,H2SiO3 ______H3PO4。
(2)碱性:Ca(OH)2 ______Mg(OH)2,Mg(OH)2 ______Al(OH)3。
(3)简单氢化物的稳定性:H2O ______H2S,H2S ______HCl。
(4)还原性:H2O ______H2S,H2S ______HCl。
(5)酸性:H2SO4 ______H2SO3,HClO4 ______HClO。
(6)从以上答案中可以归纳出:
①元素的非金属性越强,其最高价氧化物对应的水化物的酸性越______;
②元素的金属性越强,其最高价氧化物对应的水化物的碱性越______;
③元素的______性越强,其对应简单氢化物的稳定性越强;
④非金属性越强的元素生成的简单氢化物的还原性越______;
⑤同种非金属元素形成的氧化物对应的水化物,其成酸元素的价态越高,其酸性越______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为探究AgCl沉淀的溶解和转化,其实验方案及记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合,过滤,得滤液X和白色沉淀Y | |
Ⅱ.向滤液X 中滴加几滴饱和KI溶液 | 生成黄色沉淀M |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀Y 转化为黑色沉淀Z |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀Y逐渐溶解 |
(1)由步骤Ⅱ的现象可推测,滤液 X 中除了含有Na+、NO3-,还含有的离子有_____。
(2)写出步骤Ⅲ中生成黑色沉淀 Z 的离子方程式为_________________,白色沉淀Y 转化为黑色沉淀 Z 的主要原因是___________。
(3)已知:Ag+ + 2NH3· H2OAg(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因__________________。
(4)为了进一步探究银的难溶化合物沉淀溶解的多样性,该同学又做了如下对比实验 V:
①取少量黑色沉淀 Z 和黄色沉淀 M,分置于两支试管中
②然后分别滴加同体积同浓度的稀硝酸,观察到黄色沉淀 M 不溶解,黑色沉淀 Z 溶解,并且有无色气体产生。综合实验Ⅱ至实验 V 的信息,下列预测正确的是__________
A.黑色沉淀 Z 比黄色沉淀 M 更难溶于水
B.黑色沉淀 Z 溶解于稀硝酸是因为发生了氧化还原反应
C.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
D.在步骤Ⅳ之后,继续滴加浓硝酸后又有 AgCl 沉淀生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com