
【题目】随着科技的进步,合理利用资源、保护环境成为当今社会关注的焦点。甲胺铅碘(CH3NH3PbI3)用作全固态钙钛矿敏化太阳能电池的敏化剂,可由CH3NH2、PbI2及HI为原料合成,回答下列问题:
(1)制取甲胺的反应为CH3OH(g)+NH3(g)CH3NH2(g)+H2O(g) ΔH。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N | C—H |
键能/kJ·mol-1 | 351 | 463 | 393 | 293 | 414 |
则该反应的ΔH=_________kJ·mol-1。
(2)上述反应中所需的甲醇工业上利用水煤气合成,反应为CO(g)+2H2(g) CH3OH(g) ΔH <0。在一定条件下,将1 mol CO和2 mol H2通入密闭容器中进行反应,当改变某一外界条件(温度或压强)时,CH3OH的体积分数φ(CH3OH)变化趋势如图所示:
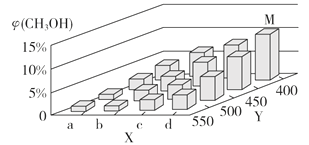
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为_________。
②X轴上a点的数值比b点_________ (填“大”或“小”)。某同学认为上图中Y轴表示温度,你认为他判断的理由是________________________________。
(3)工业上可采用CH3OH CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
CO+2H2的方法来制取高纯度的CO和H2。我国学者采用量子力学方法,通
过计算机模拟,研究了在钯基催化剂表面上甲醇制氢的反应历程,其中吸附在钯催化剂表面上的物种用*标注。
甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式 A:CH3OH* →CH3O* +H* Ea= +103.1kJ·mol-1
方式 B:CH3OH* →CH3* +OH* Eb= +249.3kJ·mol-1
由活化能E值推测,甲醇裂解过程主要历经的方式应为_________(填A、B)。
下图为计算机模拟的各步反应的能量变化示意图。
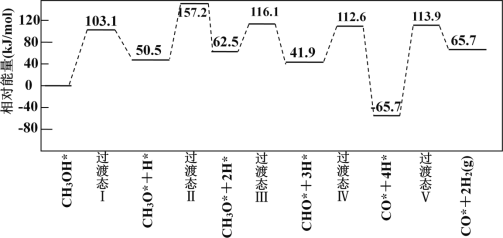
该历程中,放热最多的步骤的化学方程式为______________________________________________。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则Ksp(PbI2)=_________。
【答案】-12 25% 小 随着Y值的增大,φ(CH3OH)减小,平衡CO(g)+2H2(g)CH3OH(g)向逆反应方向进行,故Y为温度 A CHO*+3H*=CO*+4H*(或CHO*=CO*+H*) 4×10-9
【解析】
⑴未断键的可以不计算,只计算断键和成键的,计算该反应的ΔH。
⑵按照三步走书写,再计算转化率;根据图象得出X轴上a点的数值比b点小;根据随着Y值的增大,φ(CH3OH)减小,平衡CO(g)+2H2(g)CH3OH(g)向逆反应方向进行,故Y为温度。
(3)由活化能E值推测,甲醇裂解过程主要历经的方式应为A,根据图象得出,放热最多的步骤是CHO*+3H*的反应阶段。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,根据离子浓度来进行计算,
⑴未断键的可以不计算,只计算断键和成键的,因此该反应的ΔH=351 + 393 – 293 – 463 = -12 kJ·mol-1,故答案为:-12。
⑵
CO(g) + 2H2(g) CH3OH(g)
开始:1mol 2mol 0
转化:xmol 2xmol xmol
平衡:(1-x)mol (2-2x)mol xmol
![]() ,解得x = 0.25 mol,
,解得x = 0.25 mol,![]()
①平衡时,M点CH3OH的体积分数为10%,则CO的转化率为25%,故答案为:25%。
②根据图象得出X轴上a点的数值比b点小,某同学认为上图中Y轴表示温度,其判断的理由是随着Y值的增大,φ(CH3OH)减小,平衡CO(g)+2H2(g)CH3OH(g)向逆反应方向进行,故Y为温度,故答案为:小;随着Y值的增大,φ(CH3OH)减小,平衡CO(g)+2H2(g)CH3OH(g)向逆反应方向进行,故Y为温度。
(3)由活化能E值推测,甲醇裂解过程主要历经的方式应为A,该历程中,放热最多的步骤是CHO*+3H*的反应阶段,因此该反应的化学方程式为CHO*+3H*=CO*+4H*(或CHO*=CO*+H*),故答案为:A;CHO*+3H*=CO*+4H*(或CHO*=CO*+H*)。
(4)常温下,PbI2饱和溶液(呈黄色)中c(Pb2+)=1.0×10-3 mol·L-1,则![]() ,故答案为:4×10-9。
,故答案为:4×10-9。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种。将13.8 g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9 g沉淀。下列关于样品所含杂质的判断正确的是
A.肯定没有KNO3
B.肯定有KNO3,可能还有Na2CO3
C.肯定没有Ba(NO3)2,可能有KNO3
D.肯定没有Na2CO3和 Ba(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )
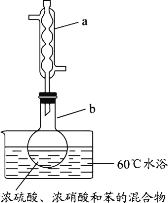
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应先向浓硝酸中缓缓加入浓硫酸,待冷却至室温后,再将苯逐滴滴入
C.仪器a的作用是冷凝回流,提高原料的利用率
D.反应完全后,可用仪器a、b蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是“国际化学元素周期表年”。1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法不正确的是( )

A.元素甲的原子结构示意图为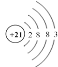
B.原子半径比较:甲>乙>Si
C.元素乙的简单气态氢化物的稳定性比CH4弱
D.推测乙可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
4NO(g)+6H2O(g),H=-akJmol-1,在5L密闭容器投入1molNH3和1mol的O2,2分钟后NO的物质的量增加了0.4mol,下列说法正确的是( )
A.2分钟反应放出的热量值小于0.1akJ
B.用氧气表示0~2min的反应速率:v(O2)=0.05mol·L-1·min-1
C.2分钟内NH3的转化率是50%
D.2分钟末c(H2O)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“![]() ”或“
”或“![]() ”回答下列问题。
”回答下列问题。
(1)酸性:H2CO3 ______H2SiO3,H2SiO3 ______H3PO4。
(2)碱性:Ca(OH)2 ______Mg(OH)2,Mg(OH)2 ______Al(OH)3。
(3)简单氢化物的稳定性:H2O ______H2S,H2S ______HCl。
(4)还原性:H2O ______H2S,H2S ______HCl。
(5)酸性:H2SO4 ______H2SO3,HClO4 ______HClO。
(6)从以上答案中可以归纳出:
①元素的非金属性越强,其最高价氧化物对应的水化物的酸性越______;
②元素的金属性越强,其最高价氧化物对应的水化物的碱性越______;
③元素的______性越强,其对应简单氢化物的稳定性越强;
④非金属性越强的元素生成的简单氢化物的还原性越______;
⑤同种非金属元素形成的氧化物对应的水化物,其成酸元素的价态越高,其酸性越______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.1 mol/L的溶液,其pH如下表所示。有关说法正确的是
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
pH | 7.0 | 7.0 | 8.1 | 8.4 |
A.酸性强弱:H2CO3>HF
B.①和②中溶质均未水解
C.离子的总浓度:①>③
D.④中:c(HCO3-) + 2c(CO32-) + c(H2CO3)![]() 0.1 mol/L
0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+与CN-、F-、有机分子等形成的化合物具有广泛的应用。
(1)Fe3+基态核外电子排布式为________。
(2)乙酰基二茂铁是常用汽油抗震剂,其结构如图甲所示。此物质中碳原子的杂化方式是__________。
(3)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________。已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为__________________。
(5)F-不仅可与Fe3+形成3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,其结构如图乙所示,则该晶体的化学式为__________________________。
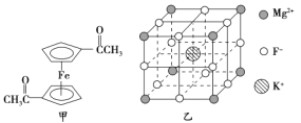
【答案】 1s22s22p63s23p63d5(或3d5) sp3、sp2 N>O>C CO(或N2) 4∶3 KMgF3
【解析】(1)Fe的原子序数为26,Fe3+的基态核外电子排布式为1s22s22p63s23p63d5(或3d5)。
(2)根据图中乙酰基二茂铁的结构可知,碳原子的杂化方式有两种。其中形成碳氧双键的碳原子和五元环上的碳原子杂化方式是sp2杂化,而-CH3上的碳原子杂化方式是sp3杂化。
(3)根据元素周期律,可知同周期元素原子第一电离能随着原子序数的增加逐渐增大,由于原子轨道上电子处于全满、半满和全空时较稳定,所以第ⅡA、ⅢA族以及第ⅤA、ⅥA主族存在反常,即同周期元素第ⅡA族的第一电离能大于第ⅢA族的第一电离能,第ⅤA族的第一电离能大于第ⅥA族的第一电离能,因此![]() 、
、![]() 、
、![]() 原子的第一电离能由大到小的顺序是N>O>C。
原子的第一电离能由大到小的顺序是N>O>C。
(4)配合物K3Fe(CN)6的配体是CN-,有14个电子,因此与其互为等电子体的分子有两种:CO或N2;(CN)2是直线型分子且具有对称性,可以判断碳氮之间形成三键,碳碳之间为单键连接,其结构式为N≡C-C≡N,因此![]() 键有4个,
键有4个,![]() 键有3个,个数比为
键有3个,个数比为![]() 。
。
(5)由晶胞结构图可知:K+位于体心,F-位于棱上,Mg2+位于顶点,因此每个晶胞中有1个K+、1/4×12=3个F-,1/8×8=1个Mg2+,则该晶体的化学式为KMgF3。
【题型】综合题
【结束】
12
【题目】某树脂的合成线路如下:
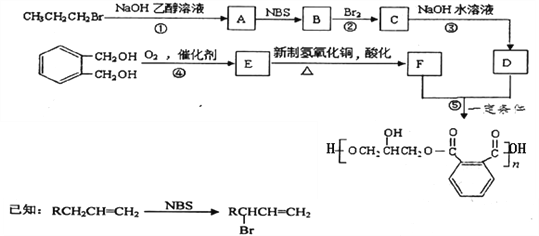
(1)B中含有的官能团的名称是________________________。
(2)反应①、③的有机反应类型分别是________________、____________________。
(3)检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是_______________。
(4)下列说法正确的是__________(填字母编号)。
a.1 mol E与足量的银氨溶液反应能生成2mol Ag
b.可以用NaHCO3鉴别E和F
c.B分子存在顺反异构
(5)写出反应⑤的化学方程式______________________________________________。
(6)![]() 的同分异构体中同时符合下列条件的芳香族化合物共有______种,其中苯环上一氯代物有两种的结构简式为_______________________。
的同分异构体中同时符合下列条件的芳香族化合物共有______种,其中苯环上一氯代物有两种的结构简式为_______________________。
a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在海洋深处的沉积物中含有大量可燃冰,主要成分是甲烷水合物。结构可以看成是甲烷分子 装在由水分子形成的笼子里。下列关于说法正确的是
A.甲烷分子和水分子的 VSEPR 模型不同
B.甲烷分子通过氢键与构成笼的水分子相结合
C.可燃冰属于分子晶体
D.水分子的键角大于甲烷分子的键角
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com