
【题目】如表所列的“依据”能推导出后面的“结论”的是
依据 | 结论 | |
A | CH4(g)+2O2(g)CO2(g)+2H2O(g)ΔH=-801.3kJ·mol-1 | CH4的标准燃烧热ΔH为-801.3kJ·mol-1 |
B | Sn(灰,s) | 锡制品在寒冷的冬天因易转化为灰状锡而损坏 |
C | 稀溶液中:H+(aq)+OH-(aq)H2O(l)ΔH=-57.3kJ·mol-1 | 中和热ΔH为57.3kJ·mol-1 |
D | C(石墨,s)+O2(g)CO2(g)ΔH=-393.5kJ·mol-1 C(金刚石,s)+O2(g)CO2(g)ΔH=-395kJ·mol-1 | 石墨转化为金刚石会放出热量 |
A.AB.BC.CD.D
【答案】B
【解析】
A.根据燃烧热的定义可知,燃烧热的化学反应方程式中水为液态,而该热化学方程式中水为气态,故不能判断燃烧热,A选项错误;
B.焓变为正值,该反应为吸热反应,可知降低温度平衡逆向移动,锡制品在寒冷的冬天因易转化为灰锡而损坏,B选项正确;
C.只有在强酸强碱的稀溶液中,H+(aq)+OH-(aq)H2O(l) ΔH=-57.3kJ·mol-1,反应的中和热才为57.3kJ/mol,一水合氨电离吸热,若是盐酸和氨水的稀溶液混合,其放出的热量小于57.3kJ/mol,C选项错误;
D.由盖斯定律,两式相减可得C(石墨,s) C(金刚石,s),ΔH=1.5kJ/mol,可知该反应为吸热反应,D选项错误;
答案选B。


科目:高中化学 来源: 题型:
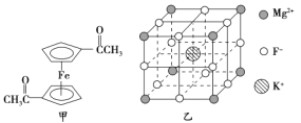
【题目】Fe3+与CN-、F-、有机分子等形成的化合物具有广泛的应用。
(1)Fe3+基态核外电子排布式为________。
(2)乙酰基二茂铁是常用汽油抗震剂,其结构如图甲所示。此物质中碳原子的杂化方式是__________。
(3)C、N、O原子的第一电离能由大到小的顺序是___________________________。
(4)配合物K3Fe(CN)6可用于电子传感器的制作。与配体互为等电子体的一种分子的化学式为________________。已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为__________________。
(5)F-不仅可与Fe3+形成3-,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,其结构如图乙所示,则该晶体的化学式为__________________________。
【答案】 1s22s22p63s23p63d5(或3d5) sp3、sp2 N>O>C CO(或N2) 4∶3 KMgF3
【解析】(1)Fe的原子序数为26,Fe3+的基态核外电子排布式为1s22s22p63s23p63d5(或3d5)。
(2)根据图中乙酰基二茂铁的结构可知,碳原子的杂化方式有两种。其中形成碳氧双键的碳原子和五元环上的碳原子杂化方式是sp2杂化,而-CH3上的碳原子杂化方式是sp3杂化。
(3)根据元素周期律,可知同周期元素原子第一电离能随着原子序数的增加逐渐增大,由于原子轨道上电子处于全满、半满和全空时较稳定,所以第ⅡA、ⅢA族以及第ⅤA、ⅥA主族存在反常,即同周期元素第ⅡA族的第一电离能大于第ⅢA族的第一电离能,第ⅤA族的第一电离能大于第ⅥA族的第一电离能,因此![]() 、
、![]() 、
、![]() 原子的第一电离能由大到小的顺序是N>O>C。
原子的第一电离能由大到小的顺序是N>O>C。
(4)配合物K3Fe(CN)6的配体是CN-,有14个电子,因此与其互为等电子体的分子有两种:CO或N2;(CN)2是直线型分子且具有对称性,可以判断碳氮之间形成三键,碳碳之间为单键连接,其结构式为N≡C-C≡N,因此![]() 键有4个,
键有4个,![]() 键有3个,个数比为
键有3个,个数比为![]() 。
。
(5)由晶胞结构图可知:K+位于体心,F-位于棱上,Mg2+位于顶点,因此每个晶胞中有1个K+、1/4×12=3个F-,1/8×8=1个Mg2+,则该晶体的化学式为KMgF3。
【题型】综合题
【结束】
12
【题目】某树脂的合成线路如下:
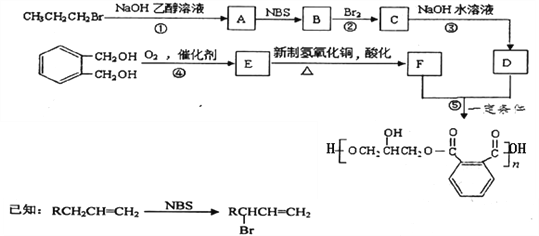
(1)B中含有的官能团的名称是________________________。
(2)反应①、③的有机反应类型分别是________________、____________________。
(3)检验CH3CH2CH2Br中的溴原子时,所加试剂的顺序依次是_______________。
(4)下列说法正确的是__________(填字母编号)。
a.1 mol E与足量的银氨溶液反应能生成2mol Ag
b.可以用NaHCO3鉴别E和F
c.B分子存在顺反异构
(5)写出反应⑤的化学方程式______________________________________________。
(6)![]() 的同分异构体中同时符合下列条件的芳香族化合物共有______种,其中苯环上一氯代物有两种的结构简式为_______________________。
的同分异构体中同时符合下列条件的芳香族化合物共有______种,其中苯环上一氯代物有两种的结构简式为_______________________。
a.能发生消去反应 b.能与过量浓溴水反应生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在海洋深处的沉积物中含有大量可燃冰,主要成分是甲烷水合物。结构可以看成是甲烷分子 装在由水分子形成的笼子里。下列关于说法正确的是
A.甲烷分子和水分子的 VSEPR 模型不同
B.甲烷分子通过氢键与构成笼的水分子相结合
C.可燃冰属于分子晶体
D.水分子的键角大于甲烷分子的键角
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有:
(i)CH4(g)+CO2(g)![]() 2CO(g)+H2(g) △H1=+247.3kJ·mol﹣1
2CO(g)+H2(g) △H1=+247.3kJ·mol﹣1
(ii)CO(g)+2H2(g)![]() CH3OH(g) △H2=﹣90.1kJ·mol﹣1
CH3OH(g) △H2=﹣90.1kJ·mol﹣1
(iii)2CO(g)+O2(g)![]() 2CO2(g) △H3=﹣566.01kJ·mol﹣1
2CO2(g) △H3=﹣566.01kJ·mol﹣1
用CH4和O2直接制备甲醇蒸气的热化学方程式为___。
(2)二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g)△H=akJmol﹣1在T1℃时,将2molSO2、1molO2充入容积为2L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3kJ,测得SO2的平衡转化率为50%,则a=___;T1℃时,上述反应的平衡常数K1=___Lmol﹣1。若将初始温度为T1℃的2molSO2和1molO2充入容积为2L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1___K2(填“>”、“<”或“=”)。
2SO3(g)△H=akJmol﹣1在T1℃时,将2molSO2、1molO2充入容积为2L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3kJ,测得SO2的平衡转化率为50%,则a=___;T1℃时,上述反应的平衡常数K1=___Lmol﹣1。若将初始温度为T1℃的2molSO2和1molO2充入容积为2L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1___K2(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
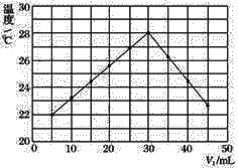
【题目】某研究小组将V1mL 1.0 mol·L-1HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(1)研究小组做该实验时环境温度________(填“高于”、“低于”或“等于”)22℃,判断的依据是_______。
(2)由题干及图形可知:V1∶V2=________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为______ mol·L-1。
(3)实验时将酸碱在简易量热计中混合,并用_______搅拌,使溶液混合均匀。经计算此反应共放出Q kJ的热量,请写出表示中和热的热化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
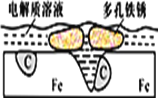
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. C是正极,O2在C表面上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国新建的某海岛发电示意图如图,已知铅蓄电池放电时的总反应为:Pb+PbO2+2H2SO4= 2PbSO4+2H2O,下列有关说法正确的是
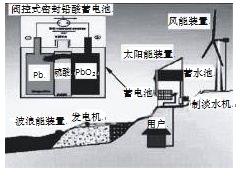
A.图中涉及的能量转化方式只有3种
B.该发电工艺可实现零排放
C.蓄电池供电时,负极的电极反应为:Pb-2e-=Pb2+
D.储能时若充电时间过长,阳极流向阴极的气体可能是H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物的水溶液中,只可能含有以下离子中的若干种:K+、Mg2+、Fe2+、Al3+、NH4+、Cl、CO32 和SO42。现每次取100.00mL进行实验:(已知:NH4++OH - ![]() NH3↑ +H2O)
NH3↑ +H2O)
① 第一份加入AgNO3溶液有沉淀产生;
② 第二份加入足量NaOH后加热,收集到气体0.896 L(标准状况下)
③ 第三份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。请回答:
(1)c(CO32) =_________mol/L;
(2)K+ 是否存在?__________;若存在,浓度范围是__________(若不存在,则不必回答第2问);
(3)根据以上实验,不能判断______(填离子符号)是否存在。若存在此离子,如何进行检验?_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氰基丙烯酸酯是一种用途广泛且具有粘性的材料,其合成原理如图:

已知:RCN在一定条件下,发生水解反应,其产物为RCOOH和NH3。
下列说法正确的是
A.M能使酸性高锰酸钾溶液褪色,不能使溴水褪色
B.上述反应类型是缩聚反应
C.1molM的水解产物最多消耗1molNaOH
D.若R为甲基,N的平均相对分子质量为11100,则n=100
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com