
【题目】某化学兴趣小组的同学买来一瓶“84”消毒液,请大家与他们一同来研讨以下问题:
(1)此瓶“84”消毒液的说明书上这样写道:“本品为无色液体,呈碱性……”,请你推测它的有效成分( )(填序号)。
A.Cl2
B.H2O2
C.NaClO
D.KMnO4
(2)该化学兴趣小组的同学在瓷碗中盛放20 mL的“84”消毒液,露置在阳光充足的室内,他们对“84”消毒液的消毒效果和组成成分的变化进行了研究。得出数据如下: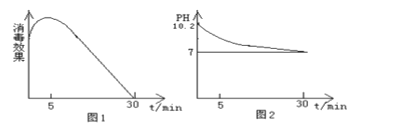
从数据图1和图2可得知“84”消毒液暴露在空气中半小时后,“84”消毒液中的主要溶质是 , 用化学方程式或离子方程式表示其中变化的主要原因
、、。
(3)该化学兴趣小组的同学选了紫色石蕊试液对“84”消毒液的性质进行实验检验,请你帮助他们完成实验报告:
实验操作 | 预期现象 | 结论 |
(4)该化学实验小组同学上网查询有关“84”消毒液的信息时,发现这样一则消息:有一家庭主妇把抗SARS用的“84”消毒液和清洁剂(呈酸性、含Cl-)都倒出一些混合在一起,进行刷洗。一会儿,她就晕倒在房间里。这几位同学感到迷惑不解。请你用离子方程式帮助他们解开这一悬念。
【答案】
(1)C
(2)氯化钠(或NaCl);2NaClO+CO2+H2O===2HClO+Na2CO3;2HClO ![]() 2HCl+O2↑;2HCl+Na2CO3===CO2↑+H2O+2NaCl(写离子方程式也可)
2HCl+O2↑;2HCl+Na2CO3===CO2↑+H2O+2NaCl(写离子方程式也可)
(3)
实验操作 | 预期现象 | 结论 |
取一干净试管,加 入1~2 mL“84” 消毒液,然后滴加 几滴紫色石蕊试液 | 先变蓝 后褪色 | “84”消毒液具有碱性和氧化性(或漂白性) |
(4)ClO-+Cl-+2H+===Cl2↑+H2O
【解析】(1)通过“本品为无色液体,”即可排除A.Cl2和D.KMnO4;通过“呈碱性……”可知为C.NaClO。(2)从数据图1和图2可得知“84”消毒液暴露在空气中半小时后,消毒效果几乎为零,溶液pH接近为7,溶液中的主要溶质应该是氯化钠(或NaCl),所发生反应的化学方程式或离子方程式表示为2NaClO+CO2+H2O===2HClO+Na2CO32HClO ![]() 2HCl+O2↑2HCl+Na2CO3===CO2↑+H2O+2NaCl(或2ClO-+CO2+H2O===2HClO+CO32-2HClO
2HCl+O2↑2HCl+Na2CO3===CO2↑+H2O+2NaCl(或2ClO-+CO2+H2O===2HClO+CO32-2HClO ![]() 2H++2Cl-+O2↑2H++CO===CO2↑+H2O)。(3)由于“84”消毒液具有碱性和氧化性(或漂白性),紫色石蕊试液遇“84”消毒液出现先变蓝后褪色的实验现象。(4)不同品牌洁污剂混合使用可能发生氯气中毒。“84”消毒液与清洁剂(呈酸性、含Cl-)混合,ClO-在酸性条件下能氧化Cl-生成氯气,发生反应的离子方程式是:ClO-+Cl-+2H+===Cl2↑+H2O。
2H++2Cl-+O2↑2H++CO===CO2↑+H2O)。(3)由于“84”消毒液具有碱性和氧化性(或漂白性),紫色石蕊试液遇“84”消毒液出现先变蓝后褪色的实验现象。(4)不同品牌洁污剂混合使用可能发生氯气中毒。“84”消毒液与清洁剂(呈酸性、含Cl-)混合,ClO-在酸性条件下能氧化Cl-生成氯气,发生反应的离子方程式是:ClO-+Cl-+2H+===Cl2↑+H2O。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1: 
已知:①软锰矿主要成分为MnO2 , 含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)已知:(图2)表二 表二
实验序号 | SO2浓度(gm﹣3) | 烟气流速(mLmin﹣1) |
① | 4.1 | 55 |
② | 4.1 | 96 |
下列措施可提高SO2吸收率的是(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是 .
(4)锰酸锂可充电电池(图3)的总反应式为:Li1﹣xMnO4+LixC ![]() LiMnO4+C(x<1) ①放电时,电池的正极反应式为
LiMnO4+C(x<1) ①放电时,电池的正极反应式为
②充电时,若转移1mole﹣ , 则石墨电极将增重g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.氧化还原反应的本质是化合价发生变化
B.有单质产生的分解反应一定是氧化还原反应
C.某元素从化合态变为游离态时,该元素一定被还原
D.还原剂在反应中发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】作催熟剂的物质除乙烯外,还有氯酸镁。实验室制备少量氯酸镁晶体【Mg(ClO3)2·6H2O】的流程如下:
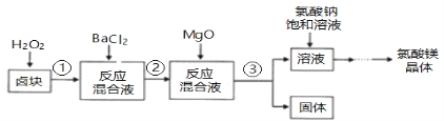

(1)步骤③的操作名称是___________,该步分离出的固体中含有多种成分,任写出一种成分的化学式__________________。
(2)用双氧水溶解卤块,H2O2的主要作用是_______________________
(3)加入饱和氯酸钠溶液发生的主要反应的反应类型是_________________(填四大基本反应类型)。
(4)若用10L饱和氯酸钠溶液(其中溶质利用率为90%),理论上可以制得氯酸镁晶体的质量是____________(用带a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活和社会可持续发展密切相关,下列说法正确的是( )
A.煤的干馏是物理变化
B.为防止食品氧化变质,包装袋中常放入生石灰
C.淀粉遇碘变蓝,可用米汤检验加碘盐中是否加碘
D.推广使用新能源汽车能够减少不可再生资源的消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为。
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[xMg(OH)2yMgCO3]
(2)为了确定产物成份(包括产生的气体、白色不溶物及溶液中溶质),进行以下定性实验。请填写表中空白:
实验序号 | 实 验 | 实验现象 | 结 论 |
实验Ⅱ | 将实验I中收集到的气体点燃 | 安静燃烧,火焰呈淡蓝色 | 气体成分为① |
实验Ⅲ | 将实验I中的白色不溶物滤出、洗涤,取少量加入足量② | ③ | 白色不溶物中含有MgCO3 |
实验Ⅳ | 取实验Ⅲ中的滤液,向其中加入适 | 产生白色沉淀,溶液红色变浅 | 溶液中存在CO32-离子 |
(3)为进一步确定实验I中白色不溶物的成分,进行以下定量实验,装置如图所示: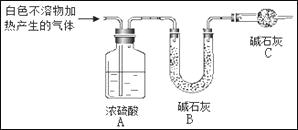
称取干燥、纯净的白色不溶物 4.52 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.36 g,装置B增重1.76 g。
①装置C的作用是;
②白色不溶物的化学式为。
(4)根据以上(2)及(3)的定性定量实验,写出镁与饱和碳酸氢钠溶液反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法正确的是
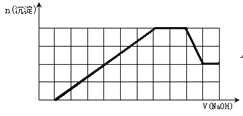
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中含有的Fe3+和Al3+的物质的量之比为1∶1
C. 原溶液中一定含有SO42-和Na+
D. 反应最后形成的溶液中含有的溶质只有Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的是( )
A.用NaHCO3溶液鉴别乙醇、乙酸和苯
B.苯和浓溴水混合,加入铁作催化剂制溴苯
C.裂化汽油可用作萃取剂来萃取溴水中的溴
D.除去乙烷中的乙烯,将混合气体通过盛有酸性KMnO4溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酿造厂生产的“老谢琼醋”是一种优质琼醋。某高二年级研究性学习小组,运用酸碱中和滴定的原理对“老谢琼醋”进行了定量分析,以测定其中的酸(全部以醋酸CH3COOH计)的含量:用酸式滴定管取10.00 mL这种琼醋,置于已知质量的小烧杯中称得其质量为12.5 g,再用100 mL容量瓶稀释至100 mL,滴定时每次取20.00 mL于锥形瓶中,而选用的标准溶液是0.112 5 mol/L NaOH溶液,以及合适的指示剂。读取的数据记录如下,其中第3次滴定的读数请从下图中读取。
滴定次数 | 用去NaOH溶液的体积 | ||
滴定前刻度 | 滴定后刻度 | 体积(mL) | |
1 | 3.20 | 22.48 | |
2 | 1.23 | 20.55 | |
3 | — | — | |
(1)请把有关数据填入表中所有空格里。
(2)琼醋样品从取出、称量、稀释到取液过程中,下列仪器水洗后不应再用相应琼醋润洗的仪器是()
A.酸式滴定管
B.烧杯
C.100 mL容量瓶
D.锥形瓶
(3)滴定时在锥形瓶底垫一张白纸的作用。
(4)滴定操作时,左手应 , 观察滴定管里液面的高度时应注意。
(5)选用的合适指示剂是 , 变色情况是。
(6)计算稀释后容量瓶中醋酸的物质的量浓度。
(7)计算“老谢琼醋”中醋酸的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com