
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1: 
已知:①软锰矿主要成分为MnO2 , 含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)已知:(图2)表二 表二
实验序号 | SO2浓度(gm﹣3) | 烟气流速(mLmin﹣1) |
① | 4.1 | 55 |
② | 4.1 | 96 |
下列措施可提高SO2吸收率的是(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是 .
(4)锰酸锂可充电电池(图3)的总反应式为:Li1﹣xMnO4+LixC ![]() LiMnO4+C(x<1) ①放电时,电池的正极反应式为
LiMnO4+C(x<1) ①放电时,电池的正极反应式为
②充电时,若转移1mole﹣ , 则石墨电极将增重g.
【答案】
(1)ad
(2)H2O2
(3)除去铁、铝元素
(4)Li1﹣xMnO4+xLi++xe﹣=LiMn2O4;7
【解析】解:(1)a.降低通入含硫烟气的温度,可提高SO2吸收率.a正确;b.升高通入含硫烟气的温度,不能提高SO2吸收率.b错误;c.减少软锰矿浆的进入量,不能提高SO2吸收率.c错误;d.减小通入含硫烟气的流速,可提高SO2吸收率.d正确.所以答案是:ad;(2)将亚铁离子氧化成铁离子,应选择H2O2 , 所以答案是:H2O2;(3)加氨水调溶液pH在5~6之间,使Fe3+、Al3+阳离子转化为氢氧化铁、氢氧化铝沉淀而除去,所以答案是:除去铁、铝元素;(4)①根据总反应式可知Li失去电子,电池负极反应式为:xLi﹣xe﹣═xLi+ , 由总反应式减去负极反应式可得放电时的正极反应式为Li1﹣xMnO4+xLi++xe﹣═LiMnO4 , 所以答案是:Li1﹣xMnO4+xLi++xe﹣═LiMnO4;
②充电时,若转移1mole﹣ , 则石墨电极上产生1molLi,质量为1mol×7g/mol=7g,
所以答案是:7.


科目:高中化学 来源: 题型:
【题目】已知:Ksp(AgCl)=1.8×10﹣10 , Ksp(AgI)=1.5×10﹣16 , Ksp(AgBr)=7.7×10﹣13 , 则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI>AgBr
B.AgCl>AgBr>AgI
C.AgBr>AgCl>AgI
D.AgBr>AgI>AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36 的X、Y、Z、W四种元素,其中X 形成的单质是最轻的物质,Y 原子基态时最外层电子数是其内层电子数的2 倍,Z原子基态时2p 原子轨道上有3 个未成对的电子,W 的原子序数为29.回答下列问题:
(1)Y2X2 中Y原子的杂化类型为 , 1mol Y2X2 含有σ键的数目为 .
(2)Y的一种氧化物与Z 的一种氧化物互为等电子体,Z 的这种氧化物分子式是 .
(3)标准状况2.24L Z 的简单氢化物溶于Z 的最高价氧化物的水化物稀溶液,放热Q kJ,该反应的热化学方程式为 .
(4)元素W 的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 , 氯化物晶体溶于足量Z 的最高价氧化物的水化物的浓溶液反应的离子方程式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 能电离出H+的化合物叫做酸
B. 氧化还原反应中,得电子越多,氧化性越强
C. 实验测得1mol某气体体积为22.4L,测定条件一定是标准状况
D. 氢氧化钡在水溶液中的电离方程式为:Ba(OH)2=Ba2++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得BeCl2为共价化合物,两个Be﹣Cl键间的夹角为180°,由此可判断BeCl2属于( )
A.由极性键形成的极性分子
B.由极性键形成的非极性分子
C.由非极性键形成的极性分子
D.由非极性键形成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
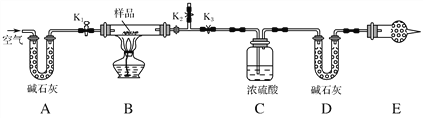
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_________________________________________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是___________________。
②E处干燥管中盛放的药品是________,其作用是__________________ ________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量________(填“偏大”、“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究物质性质的基本程序是一个系统化的过程,其主干可分为四个步骤:
①观察物质的外观; ②实验和观察; ③解释和结论; ④预测物质的性质。
排列顺序正确的是
A. ②①④③ B. ①②③④ C. ①④②③ D. ④①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组为了验证在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略)。

请按要求回答下列问题:
(1)写出烧瓶中发生反应的离子方程式_______________________________。
(2)①装置B中盛放的试剂名称是____________,作用是___________,现象是______________;
②装置D和E出现的不同现象说明的问题是__________________________________;
③写出G中发生反应的离子方程式____________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置
___________之间(填装置字母序号)增加一个装置,所增加装置里面的试剂可以为_______(填字母序号)
a. 湿润的碘化钾淀粉试纸 b. 浓硫酸
c. 湿润的红色布条 d. 饱和食盐水
(4)A装置中分液漏斗内所用溶液浓度为12 mol/L,现欲用其配制100 mL 2 mol/L的稀溶液。则需量取________ mL浓溶液,量取所用量筒的规格是________(选填“10mL”、“25mL”或“50mL”)。若所配制的稀溶液浓度偏大,则下列可能的原因分析中正确的是__________
a. 配制前,容量瓶中有少量蒸馏水 b. 量取浓溶液时,仰视液面
c. 未经冷却,立即转移至容量瓶定容 d. 定容时,仰视液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学买来一瓶“84”消毒液,请大家与他们一同来研讨以下问题:
(1)此瓶“84”消毒液的说明书上这样写道:“本品为无色液体,呈碱性……”,请你推测它的有效成分( )(填序号)。
A.Cl2
B.H2O2
C.NaClO
D.KMnO4
(2)该化学兴趣小组的同学在瓷碗中盛放20 mL的“84”消毒液,露置在阳光充足的室内,他们对“84”消毒液的消毒效果和组成成分的变化进行了研究。得出数据如下: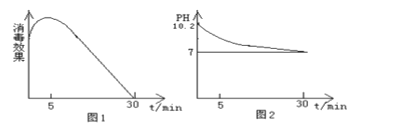
从数据图1和图2可得知“84”消毒液暴露在空气中半小时后,“84”消毒液中的主要溶质是 , 用化学方程式或离子方程式表示其中变化的主要原因
、、。
(3)该化学兴趣小组的同学选了紫色石蕊试液对“84”消毒液的性质进行实验检验,请你帮助他们完成实验报告:
实验操作 | 预期现象 | 结论 |
(4)该化学实验小组同学上网查询有关“84”消毒液的信息时,发现这样一则消息:有一家庭主妇把抗SARS用的“84”消毒液和清洁剂(呈酸性、含Cl-)都倒出一些混合在一起,进行刷洗。一会儿,她就晕倒在房间里。这几位同学感到迷惑不解。请你用离子方程式帮助他们解开这一悬念。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com