
【题目】某校化学实验兴趣小组为了验证在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略)。

请按要求回答下列问题:
(1)写出烧瓶中发生反应的离子方程式_______________________________。
(2)①装置B中盛放的试剂名称是____________,作用是___________,现象是______________;
②装置D和E出现的不同现象说明的问题是__________________________________;
③写出G中发生反应的离子方程式____________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置
___________之间(填装置字母序号)增加一个装置,所增加装置里面的试剂可以为_______(填字母序号)
a. 湿润的碘化钾淀粉试纸 b. 浓硫酸
c. 湿润的红色布条 d. 饱和食盐水
(4)A装置中分液漏斗内所用溶液浓度为12 mol/L,现欲用其配制100 mL 2 mol/L的稀溶液。则需量取________ mL浓溶液,量取所用量筒的规格是________(选填“10mL”、“25mL”或“50mL”)。若所配制的稀溶液浓度偏大,则下列可能的原因分析中正确的是__________
a. 配制前,容量瓶中有少量蒸馏水 b. 量取浓溶液时,仰视液面
c. 未经冷却,立即转移至容量瓶定容 d. 定容时,仰视液面
【答案】 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 无水硫酸铜 验证有水蒸气挥发出来 固体由白色变为蓝色 干燥的氯气无漂白性,次氯酸有漂白性 Ag++Cl-=AgCl↓ F G ac 16.7 25mL b c
Mn2++Cl2↑+2H2O 无水硫酸铜 验证有水蒸气挥发出来 固体由白色变为蓝色 干燥的氯气无漂白性,次氯酸有漂白性 Ag++Cl-=AgCl↓ F G ac 16.7 25mL b c
【解析】本题主要考查对于“验证在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质”实验的评价。
(1)烧瓶中发生反应的离子方程式:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)①装置B中盛放的试剂名称是无水硫酸铜,作用是验证有水蒸气挥发出来,现象是固体由白色变为蓝色;
②装置D和E出现的不同现象说明的问题是干燥的氯气无漂白性,次氯酸有漂白性;
③G中发生反应的离子方程式:Ag++Cl-=AgCl↓ 。
(3)为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置FG之间增加一个装置,验证没有氯气存在,所增加装置里面的试剂可以为ac。
(4)c浓V浓= c稀V稀,V浓=c稀V稀/c浓=2×100/12mL=16.7mL,则需量取16.7mL浓溶液,量取所用量筒的规格是25mL。若所配制的稀溶液浓度偏大,则下列可能的原因分析中正确的是bc。因为a. 不影响结果;b. 量取浓溶液体积增大,所配制的稀溶液浓度偏大;c. 溶液体积减小,所配制的稀溶液浓度偏大;d. 所配制的稀溶液体积增大,所配制的稀溶液浓度偏小。故选bc。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
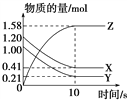
下列描述正确的是( )
A. 反应的化学方程式为X(g)+Y(g) ![]() Z(g)
Z(g)
B. 反应开始到10 s,用Z表示的反应速率为0.158 mol·L-1·s-1
C. 反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
D. 反应开始到10 s,Y的转化率为79.0%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1: 
已知:①软锰矿主要成分为MnO2 , 含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
(1)已知:(图2)表二 表二
实验序号 | SO2浓度(gm﹣3) | 烟气流速(mLmin﹣1) |
① | 4.1 | 55 |
② | 4.1 | 96 |
下列措施可提高SO2吸收率的是(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是 .
(4)锰酸锂可充电电池(图3)的总反应式为:Li1﹣xMnO4+LixC ![]() LiMnO4+C(x<1) ①放电时,电池的正极反应式为
LiMnO4+C(x<1) ①放电时,电池的正极反应式为
②充电时,若转移1mole﹣ , 则石墨电极将增重g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学仿照“喷泉”实验的原理,在实验室中做了一个“喷烟”实验,如图所示。他在甲、乙两个烧瓶中分别充入X、Y两种无色气体,在胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、NH3、Cl2、O2、CH4、SO2、NO七种气体中的两种,则下列判断中,正确的是( )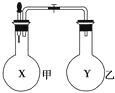
A.X是NH3 , Y是HCl
B.X是Cl2 , Y是CH4
C.X是SO2 , Y是O2
D.X是NO,Y是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向mg镁和铝的混合物重加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL.向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng.再将得到的沉淀灼烧至质量不再改变为止,得到固体pg.则下列关系不正确的是
A. c=![]() B. p=m+
B. p=m+![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]() m
m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】七铝十二钙 (12CaO·7Al2O3)是一种新型的超导材料和发光材料,它是用一定量的CaCO3溶解于酸性AlCl3溶液,再用氨水沉淀,然后煅烧沉淀制备。工业上制备七铝十二钙的流程如下图: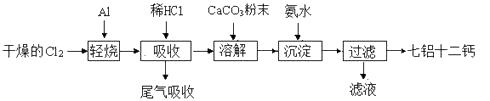
(1)轻烧后产生的AlCl3蒸气易凝华,为防止堵塞导气管可采取的措施为。
(2)吸收时用稀盐酸溶解的原因是。
(3)AlCl3溶液溶解CaCO3时,要控制碳酸钙和AlCl3的量,要求n(CaCO3)∶n(AlCl3)> 12∶14,其原因是。但若加入CaCO3过多,会产生的后果是。
(4)沉淀、过滤后的滤液主要成分是。
(5)以工业碳酸钙(含有少量Al2O3、Fe3O4杂质)生产二水合氯化钙(CaCl2·2H2O)的方法为:将工业碳酸钙溶于盐酸,加入双氧水, , 冰水洗涤,干燥,得到CaCl2·2H2O(实验中需用到的试剂和仪器有:盐酸,双氧水,氢氧化钙,冰水,pH计)。
已知:几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算):
开始沉淀的pH | 完全沉淀的pH | |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.5 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.氧化还原反应的本质是化合价发生变化
B.有单质产生的分解反应一定是氧化还原反应
C.某元素从化合态变为游离态时,该元素一定被还原
D.还原剂在反应中发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】作催熟剂的物质除乙烯外,还有氯酸镁。实验室制备少量氯酸镁晶体【Mg(ClO3)2·6H2O】的流程如下:
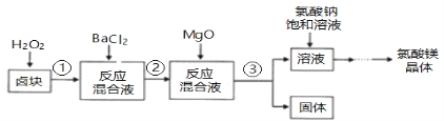

(1)步骤③的操作名称是___________,该步分离出的固体中含有多种成分,任写出一种成分的化学式__________________。
(2)用双氧水溶解卤块,H2O2的主要作用是_______________________
(3)加入饱和氯酸钠溶液发生的主要反应的反应类型是_________________(填四大基本反应类型)。
(4)若用10L饱和氯酸钠溶液(其中溶质利用率为90%),理论上可以制得氯酸镁晶体的质量是____________(用带a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的是( )
A.用NaHCO3溶液鉴别乙醇、乙酸和苯
B.苯和浓溴水混合,加入铁作催化剂制溴苯
C.裂化汽油可用作萃取剂来萃取溴水中的溴
D.除去乙烷中的乙烯,将混合气体通过盛有酸性KMnO4溶液的洗气瓶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com