
【题目】(1)现有m克某气体,它由双原子分子构成,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:
①该气体的物质的量为________mol。
②该气体所含原子总数为________个。
③该气体在标准状况下的体积为________L。
(2)将质量比为14:15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为_______,该混合气体的平均摩尔质量为_________。
(3)同温同压下,质量相同的五种气体:① CO2 ② H2 ③ O2 ④ CH4 ⑤ SO2。
所占的体积由大到小的顺序是(填序号,下同)_________________;所含原子数由多到少的顺序是__________________________;密度由大到小的顺序是__________________。
(4)在标准状况下,由CO和CO2组成的混合气体13.44L,质量为20g,该混合气体中,CO的质量是__g,CO2的体积是_____升。
【答案】m/M2mNA/M22.4m/M1:13:129g/mol②④③①⑤②④①③⑤⑤①③④②11.24.48
【解析】
(1)①根据n=m÷M可知该气体的物质的量为![]() mol。
mol。
②该气体由双原子分子构成,所以该气体所含原子总数为![]() 个。
个。
③标况下气体的摩尔体积是22.4L/mol,则该气体在标准状况下的体积为![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L。
L。
(2)将质量比为14:15的N2和NO混合,则根据n=m÷M可知混合气体中N2和NO的物质的量之比为![]() ,根据化学式可知氮原子和氧原子的个数比为3:1。根据M=m/n可知该混合气体的平均摩尔质量为
,根据化学式可知氮原子和氧原子的个数比为3:1。根据M=m/n可知该混合气体的平均摩尔质量为![]() 。
。
(3)设质量均为1g,则:
①CO2的物质的量为![]() ,含有原子的物质的量为
,含有原子的物质的量为![]() ×3=
×3=![]() ,相对分子质量为44;
,相对分子质量为44;
②H2的物质的量1g÷2g/mol=0.5mol,含有原子的物质的量为0.5mol×2=1mol,相对分子质量为2;
③O2的物质的量为![]() ,含有原子的物质的量为
,含有原子的物质的量为![]() ×2=
×2=![]() ,相对分子质量为32;
,相对分子质量为32;
④CH4的物质的量为![]() ,含有原子的物质的量为
,含有原子的物质的量为![]() ×4=0.25mol,相对分子质量为16;
×4=0.25mol,相对分子质量为16;
⑤SO2的物质的量为![]() ,含有原子的物质的量为
,含有原子的物质的量为![]() ×3=
×3=![]() ,相对分子质量为64;
,相对分子质量为64;
气体体积之比等于物质的量之比,故体积②>④>③>①>⑤;含有原子大小顺序为:②>④>①>③>⑤;相同条件下,气体密度之比等于相对分子质量,故密度⑤>①>③>④>②;
(4)在标准状况下,由CO和CO2组成的混合气体13.44L,物质的量是13.44L÷22.4L/mol=0.6mol,设混合气体中CO和CO2的物质的量分别是xmol、ymol,则x+y=0.6、28x+44y=20,解得x=0.4、y=0.2,所以该混合气体中,CO的质量是0.4mol×28g/mol=11.2g,CO2的体积是0.2mol×22.4L/mol=4.48L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.镁的氧化物熔点很高,是优质的耐高温材料
B.工业上采用热还原法来冶炼金属铁
C.二氧化硫因具有还原性,可以用来漂白纸浆
D.晶体硅是一种重要的半导体材料,是手机芯片中的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的结构与二氧化碳相似,电子式为______________,硫原子的结构示意图______________
(2)羰基硫的氢解和水解反应是两种常用的脱硫方法:
氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7kJ/mol
H2S(g)+CO(g) ΔH1=+7kJ/mol
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-34kJ/mol
H2S(g)+CO2(g) ΔH2=-34kJ/mol
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
表示CO燃烧热的热化学方程式为________。
(3)氢解反应平衡后保持温度和压强不变通入适量的He,则正反应速率___________,COS的转化率_______(填“增大”、“减小”或“不变”)。
(4)若在绝热、恒容的密闭体系中,投入一定量COS(g)和H2(g),发生氢解反应,下列示意图能说明t1时刻反应达到平衡状态的是______(填字母序号)。(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
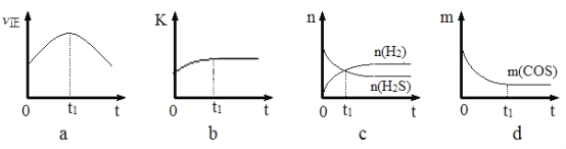
(5)某温度下,在体积为2 L密闭的容器中通入2molCOS(g)和4molH2O(g)发生上述水解反应,5 min后达到平衡,测得COS(g)的转化率是75%,回答下列问题:
①v(H2S)=________mol/(L·min)
②该温度下平衡常数K=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1HCl溶液滴定10.0mL浓度为0.1molL-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是

A. 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
B. 当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C. 当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. 当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项 | A | B | C | D |
物质 | MgCl2 | CO2 | HCl | NaOH |
所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键、共价键 |
所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 共价化合物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10 mol·L-1盐酸滴入20.00 mL 0.10mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是

A. N点所在曲线为pH变化曲线
B. M、N两点的溶液中NH4+的物质的量:M>N
C. Q点消耗盐酸的体积大于氨水的体积
D. 随着盐酸滴入,溶液导电性持续增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是( )
A.KSCN
B.BaCl2
C.HCl
D.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)![]() NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com