
【题目】已知![]() 时,几种难溶电解质的溶度积常数
时,几种难溶电解质的溶度积常数![]() 如表所示:
如表所示:
难溶电解质 | AgCl | AgBr | AgI |
|
|
Ksp |
|
|
|
|
|
下列叙述正确的是
A.溶度积常数越小该物质的溶解性一定越小
B.将浓度均为![]()
![]() 的
的![]() 溶液和
溶液和![]() 溶液等体积混合,有
溶液等体积混合,有![]() 沉淀生成
沉淀生成
C.向AgCl的悬浊液中滴加饱和NaI溶液不能得到黄色AgI
D.向100![]()
![]() 的
的![]() 溶液中加入等体积等物质的量浓度的
溶液中加入等体积等物质的量浓度的![]() 溶液,有白色沉淀生成
溶液,有白色沉淀生成
【答案】B
【解析】
A.对于结构相似的物质,溶度积常数越小,则溶解度越小,而组成、结构不相似的物质,不能根据溶度积常数大小比较溶解性,故A错误;
B.由离子的浓度可知,(2×10-3)2×(2×10-3)=8×10-9>Ksp=1.12×10-12,所以有Ag2CrO4沉淀产生,故B正确;
C.由表格中的Ksp可知,1.8×10-10>8.5×10-17,则AgI的溶度积比AgCl小,所以向AgCl的悬浊液中滴加NaI的饱和溶液可以得到黄色AgI悬浊液,故C错误;
D.由离子浓度可知,0.01×(0.01)2=10-6<Ksp=1.4×10-5,则没有白色沉淀生成,故D错误;
故选B。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】H2NNO2(硝酰胺,Nitrarnide)是一种弱酸,常温下Ka1=10-5.6。常温下,硝酰胺分解反应,H2NNO2(aq)=N2O(g)+H2O(l)的第-步为O2NNH2(aq)![]() O2NNH-(aq)+H+(aq),其中k为速率常数,υ正=k1c(O2NNH2),υ逆=k-1c(O2NNH-)·c(H+),则
O2NNH-(aq)+H+(aq),其中k为速率常数,υ正=k1c(O2NNH2),υ逆=k-1c(O2NNH-)·c(H+),则![]() 等于( )
等于( )
A.5.6B.8.4C.-5.6D.-8.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl22H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ Fe2+ Fe3+ | 4.7 7.0 1.9 | 6.7 9.0 3.2 |
(1)操作I加入X的目的是_________________________。
(2)下列物质都可以作为X,最适合本实验的X物质可以是(填选项)_________。
A.KMnO4 B.H2O2 C.NaClO D.Cl2
(3)操作II的Y试剂为(填化学式)_________,并调节溶液的pH在_________范围。
(4)操作III的程序依次为蒸发浓缩、冷却结晶、过滤、自然干燥、得到CuCl22H2O晶体。
(5)实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示):________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水中存在如下平衡:H2O+H2O![]() H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
A.加热水至100℃[其中c(H+)=1×10-6mol·L-1]B.向水中加入NaHSO4
C.向水中加入Cu(NO3)2D.在水中加入Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38。向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的关系如下图所示。计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀。下列说法正确的是 ( )

A. 原混合溶液中c(Fe3+):c(Al3+)=1:1
B. Fe(NO3)3溶液中混有杂质Al(NO3)3可以加入过量的NaOH溶液除去
C. B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104
D. C点溶液中的溶质只有NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是 ( )
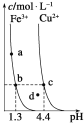
A. Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B. 加适量NH4Cl固体可使溶液由a点变到b点
C. c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将8mol H2和2molN2充入2L密闭容器中,在一定条件下进行合成氨反应,4min后反应达到平衡,测得容器中还有5.6molH2。下列计算结果错误的是( )
A.v(H2)=0.3 mol·L-1·min-1B.H2的转化率为25%
C.NH3的物质的量浓度为0.8mol·L-1D.NH3的体积分数为19.05%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学用语的理解正确的是( )
A.乙烯的结构简式:CH2CH2
B.电子式![]() 可以表示氢氧根离子,也可以表示羟基
可以表示氢氧根离子,也可以表示羟基
C.比例模型![]() 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
D.结构示意图![]() 可以表示35Cl-,也可以表示37Cl-
可以表示35Cl-,也可以表示37Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)═2SO3(g)△H<0
(1)如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为___。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图1所示。根据图示回答下列问题:

该反应的平衡常数的表达式为___,平衡状态由A变到B时,平衡常数K(A)___K(B)(填“>”、“<”或“=”)。
(3)图2表示该反应在密闭容器中达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是___;b-c过程中改变的条件可能是___;若增大压强时,反应速度变化情况画在c~d处___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com