
【题目】下列对化学用语的理解正确的是( )
A.乙烯的结构简式:CH2CH2
B.电子式![]() 可以表示氢氧根离子,也可以表示羟基
可以表示氢氧根离子,也可以表示羟基
C.比例模型![]() 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
D.结构示意图![]() 可以表示35Cl-,也可以表示37Cl-
可以表示35Cl-,也可以表示37Cl-
科目:高中化学 来源: 题型:
【题目】某化学小组设计了如图所示的数字化实验装置,研究常温下,向30 mL 0.1 mol·L1 H2A溶液中逐滴加入等浓度NaOH溶液时pH变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系(如图所示),下列说法错误的是
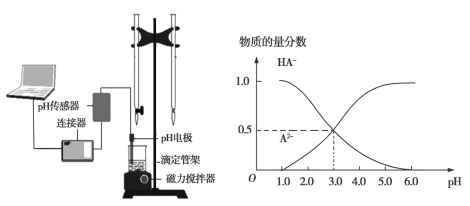
A. pH=4.0时,溶液中n(HA)约为2.73×104 mol
B. 该实验应将左边的酸式滴定管换成右边碱式滴定管
C. 常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
D. 0.1 mol·L1NaHA溶液中存在c(A2)+c(HA)+c(H2A)=0.1 mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 时,几种难溶电解质的溶度积常数
时,几种难溶电解质的溶度积常数![]() 如表所示:
如表所示:
难溶电解质 | AgCl | AgBr | AgI |
|
|
Ksp |
|
|
|
|
|
下列叙述正确的是
A.溶度积常数越小该物质的溶解性一定越小
B.将浓度均为![]()
![]() 的
的![]() 溶液和
溶液和![]() 溶液等体积混合,有
溶液等体积混合,有![]() 沉淀生成
沉淀生成
C.向AgCl的悬浊液中滴加饱和NaI溶液不能得到黄色AgI
D.向100![]()
![]() 的
的![]() 溶液中加入等体积等物质的量浓度的
溶液中加入等体积等物质的量浓度的![]() 溶液,有白色沉淀生成
溶液,有白色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时, 在pH都等于5的NH4Cl和CH3COOH两种溶液中,设由水电离产生的H+ 离子浓度分别为Amol/L与Bmol/L,则A和B关系为
A. A < B B. A = 10-4 B C. B = 10-4 A D. A = B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。

(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ag2SO4的Ksp=c2(Ag+)×c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,此时溶液中c(Ag+)=0.030mol·L-1。若t1时刻改变条件,下图中不正确的是( )
A. 加入100mL蒸馏水
加入100mL蒸馏水
B. 加入100mL0.010 mol·L-1AgSO4溶液
加入100mL0.010 mol·L-1AgSO4溶液
C. 加入100mL0.020mol·L-1Na2SO4溶液
加入100mL0.020mol·L-1Na2SO4溶液
D. 加入100mL0.040mol·L-1AgNO3溶液
加入100mL0.040mol·L-1AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+ B(g)![]() 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法错误的是( )
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法错误的是( )
A.平衡不移动
B.相当长时间后,n(A)∶n(B)∶n(C)仍为2∶2∶1
C.再达平衡时,C的体积分数增大
D.相当长时间后,正反应速率增大,逆反应速率也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )

A.反应2NO(g)+O2(g)==2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380 ℃下,c起始(O2)=5.0×10-4 mol·L-1,NO平衡转化率为50%,则平衡常数K=2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000 mol·L-1某酸(HA)溶液,溶液中HA、A-的物质的量分数δ(X)随pH的变化如图所示。[已知δ(X)=![]() ]下列说法正确的是
]下列说法正确的是
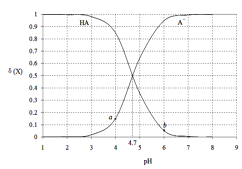
A.Ka(HA)的数量级为10-5
B.溶液中由水电离出的c(H+):a点>b点
C.当pH=4.7时,c(A-)+c(OH-)=c(HA)+c(H+)
D.当pH=7时,消耗NaOH溶液的体积为20.00mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com