
【题目】已知Ag2SO4的Ksp=c2(Ag+)×c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,此时溶液中c(Ag+)=0.030mol·L-1。若t1时刻改变条件,下图中不正确的是( )
A. 加入100mL蒸馏水
加入100mL蒸馏水
B. 加入100mL0.010 mol·L-1AgSO4溶液
加入100mL0.010 mol·L-1AgSO4溶液
C. 加入100mL0.020mol·L-1Na2SO4溶液
加入100mL0.020mol·L-1Na2SO4溶液
D. 加入100mL0.040mol·L-1AgNO3溶液
加入100mL0.040mol·L-1AgNO3溶液
【答案】D
【解析】
Ag2SO4的Ksp=c2(Ag+)×c(SO42-)=1.4×10-5,溶度积常数是一个温度常数,温度不变,溶度积常数不变,而Ag+或SO42-浓度改变,平衡发生移动,以此来解答。
A.加入蒸馏水,原饱和溶液变成不饱和溶液,Ag+、SO42-浓度均下降,说法正确,A不符合题意;
B.加入低浓度的硫酸银溶液,原饱和溶液同样要变成不饱和溶液,各离子浓度均下降,说法正确,B不符合题意;
C.加入更大浓度的硫酸钠溶液,硫酸根离子浓度加大,银离子浓度减小,说法正确。C不符合题意;
D.加入更大浓度的硝酸银溶液,银离子浓度加大,根据沉淀溶度积常数不变,可知硫酸根离子浓度必然减小,图象与事实不符合,说法错误,D符合题意;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式: ___________。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2![]() 2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:__________。
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据计算a 的数值:__________。
(3)以CO作还原剂与磷石膏反应,不同反应温度下可得到不同的产物。向盛有CaSO4的真空恒容密闭容器中充入CO,且c初始(CO)=1×10-4mol·L-1,反应体系起始总压强为0.1a MPa, 1150℃下,反应:CaSO4(s) + CO(g) ![]() CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=________MPa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
CaO(s) + CO2(g) + SO2(g)达到平衡时, CO的转化率为80%,该反应的压强平衡常数Kp=________MPa(用含a的代数式表示;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;忽略副反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1,下列热化学方程式书写正确的是( )
A. 1/2Ba(OH)2(aq)+1/2H2SO4(aq)![]() 1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
B. 1/2KOH(aq)+H2SO4(aq)![]() 1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
C. 2NaOH(aq)+H2SO4(aq)![]() Na2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
Na2SO4(aq)+2H2O(l) ΔH=-57.3 kJ·mol-1
D. KOH(aq)+1/2H2SO4(浓)![]() 1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
1/2K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓盐酸中H3AsO3与SnCl2反应的离子方程式为3Sn2++2H3AsO3+6H++18Cl-![]() 2As+3
2As+3![]() +6M关于该反应的说法中正确的组合是
+6M关于该反应的说法中正确的组合是
①氧化剂是H3AsO3
②还原性:As>SnCl2
③每生成1molAs,反应中转移电子的物质的量为3mol
④M为OH-
⑤![]() 是氧化产物
是氧化产物
A.①②④⑤B.①③⑤C.①②③④D.只有①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1mol H—H键、1mol N—H键、1molN≡N键需要的能量分别是436 kJ、391 kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___。
(2)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,回答下列问题:
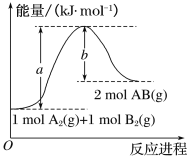
①该反应的ΔH___0(填“大于”“小于”或“等于”);
②反应物的总键能为__;
③写出该反应的热化学方程式____。
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l) ΔH1 ②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=___,联氨和N2O4可作为火箭推进剂的主要原因为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答下列问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是_____(填字母)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl![]() CH3CH2Cl+H2O
CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性最高的是______(填反应类型)。
(2)有毒物质的无害化处理也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,它可将废水中少量的CN-等有毒的酸根离子氧化而除去。请写出用ClO2将废水中的CN-氧化成无毒气体的离子方程式:______,该方法的优点是_______。
(3)某饮用水厂由天然水制备纯净水(去离子水)的工艺流程示意图如图:

活性炭的作用是_______;O3消毒的优点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,全国部分地区被雾霾笼罩,机动车尾气排放成为引发雾霾的罪魁祸首。提高空气质量,减少机动车尾气排放成为当务之急。汽车内燃机工作时引起反应:N2(g)+O2(g) ![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
断裂的共价键 | O =O | N≡N | N—O |
需要的能量 | 495 kJ·mol-1 | 945 kJ·mol-1 | 630 kJ·mol-1 |
(1)机动车发动机工作时会引发N2和O2的反应,该反应是____(填“放热”或“吸热”)反应,1 molO2与1 molN2的总能量比2 molNO的总能量___(填“大”或“小”)。
(2)N2与O2合成NO的热化学方程式可以表示为![]() N2(g)+
N2(g)+![]() O2(g)=NO(g)ΔH,则ΔH=_____。
O2(g)=NO(g)ΔH,则ΔH=_____。
(3)NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a___(填“增大”“减小”或“不变”)。
(4)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应2AB=A2+B2的能量变化如图所示,下列说法正确的是( )
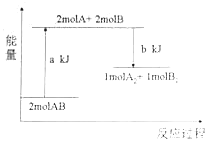
A.该反应是放热反应
B.该反应一定要在加热条件下才能进行
C.断开1molA2中的化学键和1mol B2中的化学键需吸收akJ的能量
D.1mol A2和1molB2的总能量高于2mol AB的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校实验小组欲探究硫粉与铁粉的反应,并验证反应后的产物中铁元素的化合价,如图是铁粉和硫粉反应的装置图。
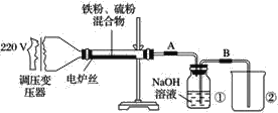
(1)将硫粉和铁粉按物质的量之比1∶1充分混合。
(2)按装置图将仪器连接好。
(3)____________。
(4)将混合物均匀地放在硬质玻璃管内。
(5)接通电源,将电压指示盘调到35 V,电炉丝很快变红,并引发左边混合物发生反应。关闭电源。
(6)将反应后的混合物冷却后加入稀硫酸中,然后取上层清液滴加硫氰酸钾溶液验证产物中铁元素的化合价。
(思考探究)
(1)步骤(3)中缺少的实验操作是什么?____。
(2)关闭电源后,反应仍继续进行的原因是什么?_____________。
(3)将盛有NaOH溶液的瓶中A、B导管位置反接是否可以?为什么?______________。
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,你认为他的说法正确吗?__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com