
【题目】某学校实验小组欲探究硫粉与铁粉的反应,并验证反应后的产物中铁元素的化合价,如图是铁粉和硫粉反应的装置图。
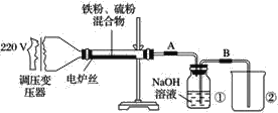
(1)将硫粉和铁粉按物质的量之比1∶1充分混合。
(2)按装置图将仪器连接好。
(3)____________。
(4)将混合物均匀地放在硬质玻璃管内。
(5)接通电源,将电压指示盘调到35 V,电炉丝很快变红,并引发左边混合物发生反应。关闭电源。
(6)将反应后的混合物冷却后加入稀硫酸中,然后取上层清液滴加硫氰酸钾溶液验证产物中铁元素的化合价。
(思考探究)
(1)步骤(3)中缺少的实验操作是什么?____。
(2)关闭电源后,反应仍继续进行的原因是什么?_____________。
(3)将盛有NaOH溶液的瓶中A、B导管位置反接是否可以?为什么?______________。
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,你认为他的说法正确吗?__________________。
【答案】检查装置的气密性 Fe粉与S粉反应是放热的,且放出的热量能使反应继续进行至反应完全 不可以,若反接会使NaOH溶液回流至未完全冷却的玻璃管中,而使玻璃管炸裂 不正确,因为反应未隔绝空气,空气中的O2参与反应会干扰实验结果
【解析】
(1)密闭环境中发生反应前,都需检验装置是否漏气。
(2)关闭电源后,反应仍继续进行,说明反应能继续提供反应时所需的热量。
(3)将盛有NaOH溶液的瓶中A、B导管位置反接,则会导致在反应结束、反应装置内压强减小时,产生倒吸。
(4)Fe2+ 具有较强的还原性,能被空气中的O2氧化为Fe3+。
(1)从以上分析可知,步骤(3)中缺少的实验操作是检查装置的气密性。答案为:检查装置的气密性;
(2)关闭电源后,反应仍继续进行,说明Fe粉与S粉反应是放热的,且放出的热量能使反应继续进行至反应完全。答案为:Fe粉与S粉反应是放热的,且放出的热量能使反应继续进行至反应完全;
(3)将盛有NaOH溶液的瓶中A、B导管位置反接,此操作不可以,因为若反接会使NaOH溶液回流至未完全冷却的玻璃管中,而使玻璃管炸裂。答案为:不可以,若反接会使NaOH溶液回流至未完全冷却的玻璃管中,而使玻璃管炸裂;
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,他的说法不正确,因为反应未隔绝空气,空气中的O2参与反应会干扰实验结果。答案为:不正确,因为反应未隔绝空气,空气中的O2参与反应会干扰实验结果。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】已知Ag2SO4的Ksp=c2(Ag+)×c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,此时溶液中c(Ag+)=0.030mol·L-1。若t1时刻改变条件,下图中不正确的是( )
A. 加入100mL蒸馏水
加入100mL蒸馏水
B. 加入100mL0.010 mol·L-1AgSO4溶液
加入100mL0.010 mol·L-1AgSO4溶液
C. 加入100mL0.020mol·L-1Na2SO4溶液
加入100mL0.020mol·L-1Na2SO4溶液
D. 加入100mL0.040mol·L-1AgNO3溶液
加入100mL0.040mol·L-1AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用惰性电极电解CuSO4溶液(如图的装置),
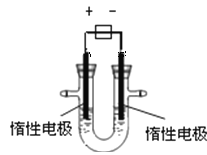
该过程中电解池电极反应式为是阳极: , 阴极: 。
(2)若电解池中装入足量溶液,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为 (假设气体全部逸出)。
(3)欲使电解液恢复到起始状态,应向溶液中加入适量的
A.CuSO4 B.H2O C.CuO D.CuSO4·5H2O
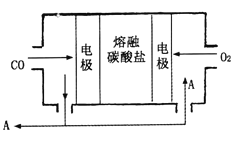
(4)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破。该电池示意图如右:负极电极反应式为_________________________,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。A物质的化学式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三支体积相等的试管分别充满相同状态下气体:①氨气;②体积比为4:l的NO2和O2气体;③NO2气体;将他们分别倒立于盛有足量水的水槽中,液面恒定后(假设试管内液体不扩散),则下列结论正确的是( )
A.①和③试管内溶液体积不等,溶质物质的量浓度也不相等
B.因为它们都可溶于水,所以液面都上升到试管顶部
C.三支试管中,试管②中溶液中溶质的物质的量浓度最小
D.试管②和试管③中溶液的溶质的物质的量浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对化学和国防工业具有重要意义。
(1)实验室欲用下图所示装置(夹持固定装置略去)制备并收集氨气。

①请在图中烧瓶内绘出导管所缺部分______________。
②试管中反应的化学方程式是____________________。
③为吸收多余的氨气,烧杯中的试剂是__________________。
(2)氨有很多重要性质。
①将酚酞溶液滴加到氨水中溶液呈红色,其原因是_______________________________。
②管道工人曾经用浓氨水检验氯气管道是否漏气,如出现白烟,说明有氯气泄露,同时还有一种相对分子质量为28的气体生成,该反应的化学方程式是__________________________。
(3)写出氨的两种用途__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将7.68g铜与50mL一定浓度的硝酸恰好完全反应,收集到标准状况下4.48L气体。
请回答:
(1)NO的体积为__L,NO2的体积为__L;
(2)被还原的硝酸的物质的量是__mol;
(3)硝酸的物质的量浓度是__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是( )

A.图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为硫酸亚铁
B.原溶液中硫酸浓度为2.5 mol·L-1
C.原混合溶液中硝酸根离子的物质的量为0.2 mol
D.图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前很多工厂实现了烟气的脱硫脱硝和氨氮废水的无害化处理,回答下列问题:
(1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含NH![]() )的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH
)的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH![]() 转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO
转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO![]() )的浓度也随之变大,写出该反应的离子方程式:___。
)的浓度也随之变大,写出该反应的离子方程式:___。
②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取wg废水样品,注入如所图示的仪器中,然后逐滴加入足量10%NaOH溶液,通入水蒸气。将样品液中的氨全部蒸出,用V1mLc1mol·L-1盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2molL-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
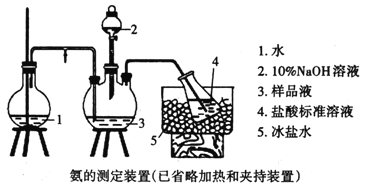
NH4Cl的电子式为___。盛放样品液的仪器是___(填名称);圆底烧瓶中长玻璃导管的作用是___;冰盐水的作用是___。
(2)某工厂利用NaClO2/(NH4)2CO3溶液脱除烟气中的SO2和NO。①保持溶液中NaClO2的浓度不变,研究(NH4)2CO3的浓度对NO和SO2脱除效率的影响[已知:(NH4)2CO3溶液显碱性;NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2]。实验结果如图所示,随着(NH4)2CO3溶液浓度的增大造成NO脱除效率下降的主要原因是___。
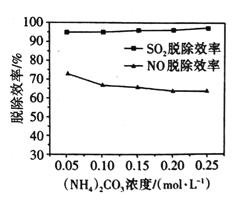
②NO脱除效率总是小于SO2脱除效率的主要原因是___。(写出一点)
(3)某工厂采用微生物硝化法处理氨氮废水,过程如图:
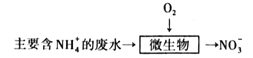
下列有关说法正确的是___(填标号)。
①微生物硝化法处理废水后会导致水体的pH升高
②若微生物保持活性的pH范围为7~9,则适宜用来调节水体pH的是CO2
③不能采用电解法在阴极将NH![]() 直接转化为NO
直接转化为NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中离子在水溶液中能大量共存且满足相应要求的是( )
选项 | 离子 | 要求 |
A | K+、NO | c(K+)<c(Cl-) |
B | Na+、NO | 逐滴滴加盐酸立即有气体产生 |
C | Na+、Al3+、Mg2+、SO | 逐滴滴加氨水立即有沉淀产生 |
D | NH | 滴加NaOH浓溶液立刻有气体产生 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com