
【题目】目前很多工厂实现了烟气的脱硫脱硝和氨氮废水的无害化处理,回答下列问题:
(1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含NH![]() )的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH
)的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH![]() 转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO
转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO![]() )的浓度也随之变大,写出该反应的离子方程式:___。
)的浓度也随之变大,写出该反应的离子方程式:___。
②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取wg废水样品,注入如所图示的仪器中,然后逐滴加入足量10%NaOH溶液,通入水蒸气。将样品液中的氨全部蒸出,用V1mLc1mol·L-1盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2molL-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
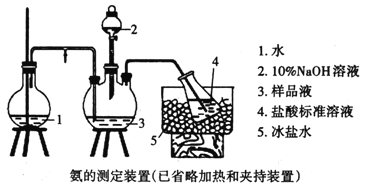
NH4Cl的电子式为___。盛放样品液的仪器是___(填名称);圆底烧瓶中长玻璃导管的作用是___;冰盐水的作用是___。
(2)某工厂利用NaClO2/(NH4)2CO3溶液脱除烟气中的SO2和NO。①保持溶液中NaClO2的浓度不变,研究(NH4)2CO3的浓度对NO和SO2脱除效率的影响[已知:(NH4)2CO3溶液显碱性;NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2]。实验结果如图所示,随着(NH4)2CO3溶液浓度的增大造成NO脱除效率下降的主要原因是___。
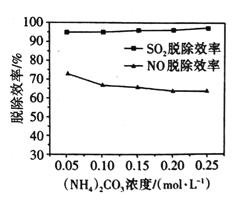
②NO脱除效率总是小于SO2脱除效率的主要原因是___。(写出一点)
(3)某工厂采用微生物硝化法处理氨氮废水,过程如图:
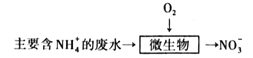
下列有关说法正确的是___(填标号)。
①微生物硝化法处理废水后会导致水体的pH升高
②若微生物保持活性的pH范围为7~9,则适宜用来调节水体pH的是CO2
③不能采用电解法在阴极将NH![]() 直接转化为NO
直接转化为NO![]()
【答案】3ClO-+NH![]() +2OH-=NO
+2OH-=NO![]() +3Cl-+3H2O
+3Cl-+3H2O 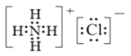 三颈烧瓶 当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或平衡气压) 冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收) (NH4)2CO3浓度增加,溶液的碱性越强,NaClO2的氧化性下降 NO的溶解度较低(或脱硝反应的活化能较高) ③
三颈烧瓶 当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或平衡气压) 冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收) (NH4)2CO3浓度增加,溶液的碱性越强,NaClO2的氧化性下降 NO的溶解度较低(或脱硝反应的活化能较高) ③
【解析】
(1)①Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO![]() )的浓度也随之变大,说明NH
)的浓度也随之变大,说明NH![]() 被氧化成NO
被氧化成NO![]() ,该反应的离子方程式:3ClO-+NH
,该反应的离子方程式:3ClO-+NH![]() +2OH-=NO
+2OH-=NO![]() +3Cl-+3H2O。故答案为:3ClO-+NH
+3Cl-+3H2O。故答案为:3ClO-+NH![]() +2OH-=NO
+2OH-=NO![]() +3Cl-+3H2O;
+3Cl-+3H2O;
②NH4Cl是离子化合物,电子式为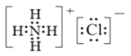 。盛放样品液的仪器是三颈烧瓶;圆底烧瓶中长玻璃导管的作用是当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或平衡气压);冰盐水的作用是冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收)。故答案为:
。盛放样品液的仪器是三颈烧瓶;圆底烧瓶中长玻璃导管的作用是当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或平衡气压);冰盐水的作用是冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收)。故答案为: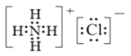 ;三颈烧瓶;当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或平衡气压);冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收);
;三颈烧瓶;当烧瓶中压力过大时,安全管中液面上升,使烧瓶中压力稳定(或平衡气压);冷却降温,防止反应放热使盐酸挥发(或降温有利于氨气的吸收);
(2)①已知:(NH4)2CO3溶液显碱性,NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2,根据图中实验结果,随着(NH4)2CO3溶液浓度的增大,造成NO脱除效率下降的主要原因是:(NH4)2CO3浓度增加,溶液的碱性越强,NaClO2的氧化性下降。故答案为:(NH4)2CO3浓度增加,溶液的碱性越强,NaClO2的氧化性下降;
②根据NO的性质,NO脱除效率总是小于SO2脱除效率的主要原因是:NO的溶解度较低(或脱硝反应的活化能较高)。故答案为:NO的溶解度较低(或脱硝反应的活化能较高);
(3)采用微生物硝化法处理氨氮废水,由图可得反应:NH4++2O2=NO3-+H2O+2H+,
①微生物硝化法处理废水后会导致水体的pH降低,故错误;
②若微生物保持活性的pH范围为7~9,调节水体pH可加入碱性物质,但不能引入新杂质,且加强碱易使微生物变性,可加入石灰石来调节水体的pH,故B错误;
③电解时,阳极发生氧化反应,不能采用电解法在阴极将NH![]() 直接转化为NO
直接转化为NO![]() ,故正确;
,故正确;
故答案为:③。


科目:高中化学 来源: 题型:
【题目】化学反应2AB=A2+B2的能量变化如图所示,下列说法正确的是( )
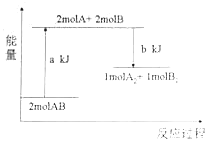
A.该反应是放热反应
B.该反应一定要在加热条件下才能进行
C.断开1molA2中的化学键和1mol B2中的化学键需吸收akJ的能量
D.1mol A2和1molB2的总能量高于2mol AB的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学校实验小组欲探究硫粉与铁粉的反应,并验证反应后的产物中铁元素的化合价,如图是铁粉和硫粉反应的装置图。
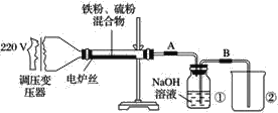
(1)将硫粉和铁粉按物质的量之比1∶1充分混合。
(2)按装置图将仪器连接好。
(3)____________。
(4)将混合物均匀地放在硬质玻璃管内。
(5)接通电源,将电压指示盘调到35 V,电炉丝很快变红,并引发左边混合物发生反应。关闭电源。
(6)将反应后的混合物冷却后加入稀硫酸中,然后取上层清液滴加硫氰酸钾溶液验证产物中铁元素的化合价。
(思考探究)
(1)步骤(3)中缺少的实验操作是什么?____。
(2)关闭电源后,反应仍继续进行的原因是什么?_____________。
(3)将盛有NaOH溶液的瓶中A、B导管位置反接是否可以?为什么?______________。
(4)某同学认为,若Fe粉与S粉反应产物中铁元素的化合价是+2价,则上述步骤(6)中的溶液不变红,你认为他的说法正确吗?__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】V2O5(五氧化二钒)可作化学工业中的催化剂,广泛用于冶金、化工等行业。工业上利用冶炼铝生成的固体废料一一赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取V2O5其工艺流程图如图:
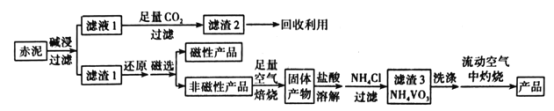
已知:①NH4VO3是白色粉末,微溶于冷水,可溶于热水。
②NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
③V2O5是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性。
④部分稀土金属氯化物在乙醇中溶解度较小。
(1)“碱浸”时对赤泥进行粉碎的目的是___。写出滤液1中通入足量CO2时所发生主要反应的离子方程式:___。
(2)将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,写出该磁性产品与稀硝酸反应的离子方程式:___。
(3)“洗涤”操作时可选用的洗涤剂有___。(填字母)
A.冷水 B.热水C.1%NH4Cl溶液 D.乙醇
(4)需在流动空气中灼烧的原因可能是___。
(5)将0.253g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250molL-1Na2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为___。
(已知:I2+2Na2S2O3=Na2S4O6+2NaI,结果保留三位有效数字)
(6)水系锌离子电池是一种新型二次电池,以Zn(CF3SO3)2(三氟甲磺酸锌)为电解质,工作原理如图。放电时V2O5电极上的电极反应式为___。
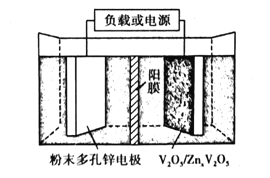
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组同学设计如图实验装置(部分夹持仪器未画出)探究氨气的还原性并检验部分产物。
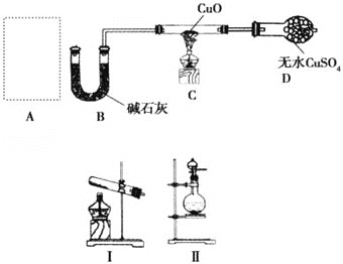
(1)若A中使用装置Ⅰ制取氨气,则化学方程式为__,发生装置试管口略向下倾斜的原因_____;若A中使用装置Ⅱ制取氨气,则分液漏斗中的试剂为__,圆底烧瓶中的固体可以为__。
(2)B中碱石灰的作用是__。
(3)氨气还原炽热氧化铜的化学方程式为__,装置C中的实验现象为__,装置D中的实验现象为__。
(4)①该装置存在明显的缺陷是__。
②请画出改进后需要增加连接的实验装置图________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某密闭恒容的容器内可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态的标志
2C(g)达到平衡状态的标志
A. A的消耗速率是C的分解速率1/2倍
B. 容器内混合气体的密度不随时间而变化
C. 单位时间内生成nmolA,同时生成3nmolB
D. A、B、C的分子数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是地球上取之不尽用之不竭的碳源,将CO2应用于生产中实现其综合利用是目前的研究热点。
(1)CO2加氢制备甲酸(HCOOH,熔点8.4℃沸点100.8℃)是利用化学载体进行H2储存的关键步骤。
已知:H2(g)+CO2(g)![]() HCOOH(l) △H1=-30.0kJmol-1
HCOOH(l) △H1=-30.0kJmol-1
2H2(g)+O2(g)=2H2O(1) △H2=-571.6kJmol-1
则表示HCOOH燃烧热的热化学方程式为___。
(2)在催化作用下由CO2和CH4转化为CH3COOH的反应历程示意图如图。
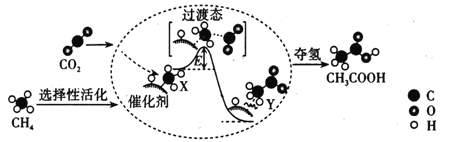
①在合成CH3COOH的反应历程中,下列有关说法正确的是___。填(字母)
a.该催化剂使反应的平衡常数增大
b.CH4→CH3COOH过程中,有C—H键发生断裂
c.由X→Y过程中放出能量并形成了C—C键
②该条件下由CO2和CH4合成CH3COOH的化学方程式为___。
(3)CO2与H2在一定条件下反应可生成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
CH3OH(g)+H2O(g) △H<0。改变温度时,该反应中的所有物质都为气态,起始温度、容积均相同(T1℃、2L密闭容器)。实验过程中的部分数据见下表:
反应时间 | n(CO2)/mol | n(H2)/mol | n(CH3OH)/mol | n(H2O)/mol | |
实验I恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
实验II绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①实验I,前10min内的平均反应速率υ(CH3OH)=___。
②平衡时CH3OH的浓度:c(实验I)___c(实验II)(填“>”、“<”或“=”,下同)。实验I中当其他条件不变时,若30min后只改变温度为T2℃,再次平衡时n(H2)=3.2mol,则T1___T2。
③已知某温度下该反应的平衡常数K=160,开始时在密闭容器中只加入CO2和H2,反应10min时测得各组分的浓度如下表,则此时υ正___υ逆。
物质 | H2 | CO2 | CH3OH | H2O |
浓度/(mol·L-1) | 0.2 | 0.2 | 0.4 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下相同体积的两种气体12C18O和14N2,下列判断正确的是( )
A.分子数目相等B.中子数相等
C.密度之比为14:15D.电子数之比为2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质由铁和氧两种元素组成,实验测得铁元素与氧元素的质量比为21∶8,关于该物质的下列说法中不正确的是( )
A.铁元素与氧元素物质的量比为3∶4
B.该物质可能为四氧化三铁
C.该物质一定为四氧化三铁
D.该物质可能为混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com