
【题目】化学反应2AB=A2+B2的能量变化如图所示,下列说法正确的是( )
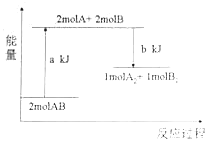
A.该反应是放热反应
B.该反应一定要在加热条件下才能进行
C.断开1molA2中的化学键和1mol B2中的化学键需吸收akJ的能量
D.1mol A2和1molB2的总能量高于2mol AB的总能量
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
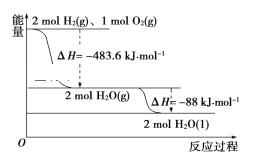
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ag2SO4的Ksp=c2(Ag+)×c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,此时溶液中c(Ag+)=0.030mol·L-1。若t1时刻改变条件,下图中不正确的是( )
A. 加入100mL蒸馏水
加入100mL蒸馏水
B. 加入100mL0.010 mol·L-1AgSO4溶液
加入100mL0.010 mol·L-1AgSO4溶液
C. 加入100mL0.020mol·L-1Na2SO4溶液
加入100mL0.020mol·L-1Na2SO4溶液
D. 加入100mL0.040mol·L-1AgNO3溶液
加入100mL0.040mol·L-1AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年5月5日晚18时00分,我国载人空间站货物返回舱试验舱在我国文昌航天发射场点火升空, 5月8日飞船试验船返回舱在东风着陆场预定区域成功着陆,试验取得圆满成功。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是Be和MgF2)为原料制备金属铍的工艺流程如图:

已知:MgF2和CaF2难溶于水。回答下列问题:
(1)提高浸出速率的方法有________、_______(任写两项);已知滤液Ⅰ中铍元素的存在形式为H2BeF4,写出“浸出”过程中发生反应的化学方程式:____________。
(2)过滤所得滤渣I的主要成分为________(填化学式)。
(3)该流程中可循环利用的物质是____________________;滤渣Ⅱ与浓硫酸发生反应的化学方程式为__________________________________________________;已知(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”具体是指____________________ 过滤、洗涤、干燥。
(4) “分解”过程中产生的BeF2在熔融状态下不能导电,其电子式为_____________;“还原”过程可以用金属镁制备金属铍的原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol·L-1,加入等体积0.3 mol·L-1的BaCl2溶液恰好使![]() 完全沉淀,则混合溶液中Na+的浓度为________。
完全沉淀,则混合溶液中Na+的浓度为________。
(2)将0.1 mol·L-1的K2SO4溶液、0.2 mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、![]() 的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
(3)在标准状况下,将一个充满HCl气体和氧气的集气瓶倒放于盛水的水槽中,水面上升至集气瓶容积的![]() ,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示。下列判断中,正确的是( )
密闭容器体积/L | 甲 | 乙 | 丙 | 丁 | |
2 | 2 | 2 | 1 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率/% | 80 | α1 | α2 | α3 | |
A.甲中反应的平衡常数小于乙
B.该温度下,甲和乙中反应的平衡常数K均为400
C.SO2的平衡转化率:α1>α2=α3
D.容器中SO3的物质的量浓度:丙>甲=丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用惰性电极电解CuSO4溶液(如图的装置),
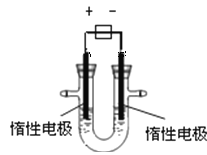
该过程中电解池电极反应式为是阳极: , 阴极: 。
(2)若电解池中装入足量溶液,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为 (假设气体全部逸出)。
(3)欲使电解液恢复到起始状态,应向溶液中加入适量的
A.CuSO4 B.H2O C.CuO D.CuSO4·5H2O
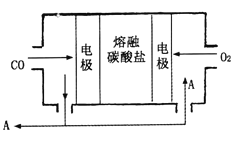
(4)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破。该电池示意图如右:负极电极反应式为_________________________,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。A物质的化学式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三支体积相等的试管分别充满相同状态下气体:①氨气;②体积比为4:l的NO2和O2气体;③NO2气体;将他们分别倒立于盛有足量水的水槽中,液面恒定后(假设试管内液体不扩散),则下列结论正确的是( )
A.①和③试管内溶液体积不等,溶质物质的量浓度也不相等
B.因为它们都可溶于水,所以液面都上升到试管顶部
C.三支试管中,试管②中溶液中溶质的物质的量浓度最小
D.试管②和试管③中溶液的溶质的物质的量浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前很多工厂实现了烟气的脱硫脱硝和氨氮废水的无害化处理,回答下列问题:
(1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含NH![]() )的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH
)的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH![]() 转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO
转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO![]() )的浓度也随之变大,写出该反应的离子方程式:___。
)的浓度也随之变大,写出该反应的离子方程式:___。
②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取wg废水样品,注入如所图示的仪器中,然后逐滴加入足量10%NaOH溶液,通入水蒸气。将样品液中的氨全部蒸出,用V1mLc1mol·L-1盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2molL-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
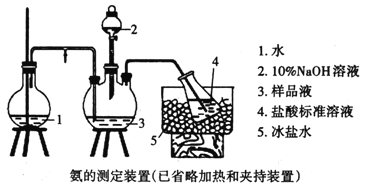
NH4Cl的电子式为___。盛放样品液的仪器是___(填名称);圆底烧瓶中长玻璃导管的作用是___;冰盐水的作用是___。
(2)某工厂利用NaClO2/(NH4)2CO3溶液脱除烟气中的SO2和NO。①保持溶液中NaClO2的浓度不变,研究(NH4)2CO3的浓度对NO和SO2脱除效率的影响[已知:(NH4)2CO3溶液显碱性;NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2]。实验结果如图所示,随着(NH4)2CO3溶液浓度的增大造成NO脱除效率下降的主要原因是___。
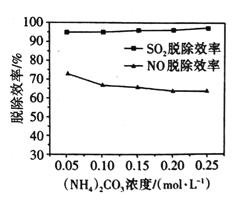
②NO脱除效率总是小于SO2脱除效率的主要原因是___。(写出一点)
(3)某工厂采用微生物硝化法处理氨氮废水,过程如图:
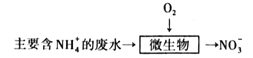
下列有关说法正确的是___(填标号)。
①微生物硝化法处理废水后会导致水体的pH升高
②若微生物保持活性的pH范围为7~9,则适宜用来调节水体pH的是CO2
③不能采用电解法在阴极将NH![]() 直接转化为NO
直接转化为NO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com