
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示。下列判断中,正确的是( )
密闭容器体积/L | 甲 | 乙 | 丙 | 丁 | |
2 | 2 | 2 | 1 | ||
起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 | 0.4 |
n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
SO2的平衡转化率/% | 80 | α1 | α2 | α3 | |
A.甲中反应的平衡常数小于乙
B.该温度下,甲和乙中反应的平衡常数K均为400
C.SO2的平衡转化率:α1>α2=α3
D.容器中SO3的物质的量浓度:丙>甲=丁
【答案】B
【解析】
A.温度相同时,该反应的平衡常数不变,则甲、乙中反应的平衡常数相等,故A错误;
B.根据 2SO2(g)+O2(g)![]() 2SO3(g),
2SO3(g),
开始(mol) 0.4 0.24 0
转化(mol) 0.32 0.16 0.32
平衡(mol) 0.08 0.08 0.32
平衡浓度(mol/L)0.04 0.04 0.16
所以该温度下,平衡常数值为![]() =400,故B正确;
=400,故B正确;
C.由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,二氧化硫转化率减小,丙和丁达到的是相同的平衡状态,丙实验氧气物质的量增大,氧气转化率增大;则二氧化硫转化率,α1<α2=α3,故C错误;
D.体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大,即丙中c(SO3)大于甲中c(SO3)的2倍,丙体积为2L,丁体积为1L,起始量分别为0.8,0.48;0.40,24,丙和丁达到的平衡相同,三氧化硫浓度相同,丙=丁>甲,故D错误;
故选B。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
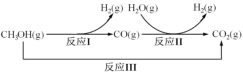
(1)已知一定条件下
反应I:CH3OH(g)=CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是___。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率见图。
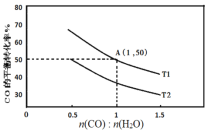
①比较T1、T2的大小,T1___T2(填“>”“<”或“=”)。
②A点对应的化学平衡常数是___。
③T1温度时,按下表数据开始反应建立平衡
CO | H2O | H2 | CO2 | |
起始浓度(mol/L) | 2 | 1 | 0 | 0 |
t时刻浓度(mol/L) | 1.2 | 0.2 | 0.8 | 0.8 |
反应进行到t时刻时,判断v(正)、v(逆)的大小关系为:v(正)___v(逆)(填“>”“<”或“=”)。
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___。
(3)CO2在生产中有着广泛的用途。
①将过量CO2通入KOH溶液中可生成KHCO3,请写出该反应的离子方程式___。
②在经CO2饱和处理的KHCO3弱酸性溶液中,电解活化CO2可以制备乙醇,原理如图所示。该电极为___(填“阴极”或“阳极”),电极反应式是___。
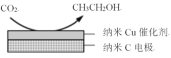
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答下列问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是_____(填字母)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl![]() CH3CH2Cl+H2O
CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性最高的是______(填反应类型)。
(2)有毒物质的无害化处理也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,它可将废水中少量的CN-等有毒的酸根离子氧化而除去。请写出用ClO2将废水中的CN-氧化成无毒气体的离子方程式:______,该方法的优点是_______。
(3)某饮用水厂由天然水制备纯净水(去离子水)的工艺流程示意图如图:

活性炭的作用是_______;O3消毒的优点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用胆矾制取氧化铜,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用,实验步骤如下:①称量ag胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;②过滤步骤①中的混合物,洗涤固体;③将②中的固体转移至蒸发皿中,加热至固体全部变成黑色氧化铜为止,称量所得固体质量为bg;④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气(装置如图所示)。请回答下列问题:
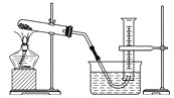
(1)上述各步操作中,需要用到玻璃棒的是________(填写前面所述实验步骤的序号)。
(2)由胆矾制得的氧化铜的产率(实际产量与理论产量的百分比)为________×100%。
(3)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应该进行的实验操作是__________(按实验先后顺序填写字母序号)。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(4)但有很大一部分同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应2AB=A2+B2的能量变化如图所示,下列说法正确的是( )
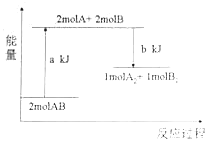
A.该反应是放热反应
B.该反应一定要在加热条件下才能进行
C.断开1molA2中的化学键和1mol B2中的化学键需吸收akJ的能量
D.1mol A2和1molB2的总能量高于2mol AB的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是( )
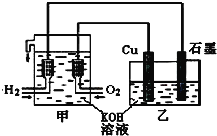
A.乙中Cu电极的电极反应式是:2Cu+2OH--2e-=Cu2O+H2O
B.甲中通入氧气的电极为负极
C.乙中阴离子向石墨电极移动
D.电路上通过0.5mol电子,可制得0.5molCu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用质量分数为36.5%的浓盐酸(密度为1.25 g·mL-1),配制240 mL 0.1mol·L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为__________。
(2)配制240 mL 0.1 mol·L-1的盐酸,应量取浓盐酸体积__________mL。
(3)应选用容量瓶的规格__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如图所示,下列有关叙述正确的是( )
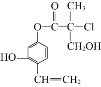
A.1molA最多可以与2molBr2发生反应
B.一个A分子中最多有8个碳原子在同一平面上
C.1molA与足量的NaOH溶液反应,最多可以消耗3molNaOH
D.在一定条件下可以发生消去反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某密闭恒容的容器内可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态的标志
2C(g)达到平衡状态的标志
A. A的消耗速率是C的分解速率1/2倍
B. 容器内混合气体的密度不随时间而变化
C. 单位时间内生成nmolA,同时生成3nmolB
D. A、B、C的分子数之比为1:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com