
【题目】V2O5(五氧化二钒)可作化学工业中的催化剂,广泛用于冶金、化工等行业。工业上利用冶炼铝生成的固体废料一一赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取V2O5其工艺流程图如图:
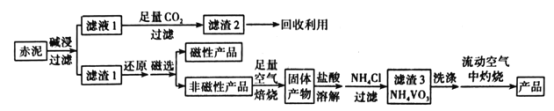
已知:①NH4VO3是白色粉末,微溶于冷水,可溶于热水。
②NH4VO3![]() V2O5+2NH3↑+H2O
V2O5+2NH3↑+H2O
③V2O5是一种橙黄色片状晶体,微溶于水,不溶于乙醇,具有强氧化性。
④部分稀土金属氯化物在乙醇中溶解度较小。
(1)“碱浸”时对赤泥进行粉碎的目的是___。写出滤液1中通入足量CO2时所发生主要反应的离子方程式:___。
(2)将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,写出该磁性产品与稀硝酸反应的离子方程式:___。
(3)“洗涤”操作时可选用的洗涤剂有___。(填字母)
A.冷水 B.热水C.1%NH4Cl溶液 D.乙醇
(4)需在流动空气中灼烧的原因可能是___。
(5)将0.253g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250molL-1Na2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为___。
(已知:I2+2Na2S2O3=Na2S4O6+2NaI,结果保留三位有效数字)
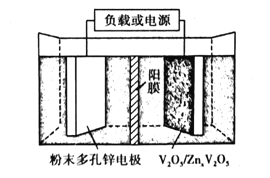
(6)水系锌离子电池是一种新型二次电池,以Zn(CF3SO3)2(三氟甲磺酸锌)为电解质,工作原理如图。放电时V2O5电极上的电极反应式为___。
【答案】加快碱浸速率并使氧化铝充分溶解 AlO![]() +2H2O+CO2=Al(OH)3↓+HCO
+2H2O+CO2=Al(OH)3↓+HCO![]() 3Fe+8H++2NO
3Fe+8H++2NO![]() =3Fe2++2NO↑+4H2O AC 把生成的NH3及时带走,防止V2O5与NH3发生氧化还原反应,影响纯度与产率 89.9% V2O5+xZn2++2xe-=ZnxV2O5
=3Fe2++2NO↑+4H2O AC 把生成的NH3及时带走,防止V2O5与NH3发生氧化还原反应,影响纯度与产率 89.9% V2O5+xZn2++2xe-=ZnxV2O5
【解析】
赤泥进行碱浸,氧化铝溶解形成偏铝酸盐,再通入二氧化碳得到氢氧化铝沉淀。滤渣1系列操作得到V2O5,可知滤渣1中含有Fe2O3、V2O5及少量稀土金属氧化物,进行还原、磁选,磁性产品中含有Fe等,非磁性产品含有V元素,在空气中焙烧后用盐酸溶解,钒在溶液中主要以VO2+和VO3-的形式存在,再加入氯化铵转化为NH4VO3,焙烧得到V2O5,由溶液中存在平衡VO2++H2O![]() VO3-+2H+,盐酸过量会抑制生成NH4VO3,盐酸溶解时不易过量。
VO3-+2H+,盐酸过量会抑制生成NH4VO3,盐酸溶解时不易过量。
(1)赤泥进行碱浸,氧化铝溶解形成偏铝酸盐,再通入二氧化碳得到氢氧化铝沉淀。“碱浸”时对赤泥进行粉碎的目的是:加快碱浸速率并使氧化铝充分溶解。滤液1中通入足量CO2时所发生主要反应的离子方程式:AlO![]() +2H2O+CO2=Al(OH)3↓+HCO
+2H2O+CO2=Al(OH)3↓+HCO![]() 。故答案为:加快碱浸速率并使氧化铝充分溶解;AlO
。故答案为:加快碱浸速率并使氧化铝充分溶解;AlO![]() +2H2O+CO2=Al(OH)3↓+HCO
+2H2O+CO2=Al(OH)3↓+HCO![]() ;
;
(2)将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,说明生成的是亚铁离子,该磁性产品与稀硝酸反应的离子方程式:3Fe+8H++2NO![]() =3Fe2++2NO↑+4H2O。故答案为:3Fe+8H++2NO
=3Fe2++2NO↑+4H2O。故答案为:3Fe+8H++2NO![]() =3Fe2++2NO↑+4H2O;
=3Fe2++2NO↑+4H2O;
(3)NH4VO3是白色粉末,微溶于冷水,可溶于热水,NH4VO3在NH4Cl溶液中溶解度较小,“洗涤”操作时可选用的洗涤剂有冷水或1%NH4Cl溶液,虽然NH4VO3不溶于乙醇,但NH4VO3表面杂质,如NH4Cl不溶于乙醇,使用乙醇不能洗去沉淀表面的杂质,不选用乙醇。故答案为:AC;
(4)根据信息,NH4VO4灼烧生成V2O5,因为V2O5具有强氧化性,能与具有还原性NH3发生反应,从而影响产物的纯度及产率。需在流动空气中灼烧的原因可能是把生成的NH3及时带走,防止V2O5与NH3发生氧化还原反应,影响纯度与产率。故答案为:把生成的NH3及时带走,防止V2O5与NH3发生氧化还原反应,影响纯度与产率;
(5)根据I2和Na2S2O3发生反应的方程式I2+2Na2S2O3═Na2S4O6+2NaI可知,消耗n(I2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×20.00×10-3L×0.250mol·L-1=2.5×10-3mol,根据得失电子数目守恒,n(V2O5)×2×2=n(I2)×2,解得:n(V2O5)=1.25×10-3mol,则m(V2O5)=1.25×10-3×182g=0.2275g,则该产品的纯度为:
×20.00×10-3L×0.250mol·L-1=2.5×10-3mol,根据得失电子数目守恒,n(V2O5)×2×2=n(I2)×2,解得:n(V2O5)=1.25×10-3mol,则m(V2O5)=1.25×10-3×182g=0.2275g,则该产品的纯度为:![]() ×100%=89.9%;
×100%=89.9%;
故答案为:89.9%;
(6)放电时,锌作负极,失电子,V2O5在正极上得电子,发生还原反应,生成ZnxV2O5,放电时V2O5电极上的电极反应式为V2O5+xZn2++2xe-=ZnxV2O5。
故答案为:V2O5+xZn2++2xe-=ZnxV2O5。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】2020年5月5日晚18时00分,我国载人空间站货物返回舱试验舱在我国文昌航天发射场点火升空, 5月8日飞船试验船返回舱在东风着陆场预定区域成功着陆,试验取得圆满成功。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是Be和MgF2)为原料制备金属铍的工艺流程如图:

已知:MgF2和CaF2难溶于水。回答下列问题:
(1)提高浸出速率的方法有________、_______(任写两项);已知滤液Ⅰ中铍元素的存在形式为H2BeF4,写出“浸出”过程中发生反应的化学方程式:____________。
(2)过滤所得滤渣I的主要成分为________(填化学式)。
(3)该流程中可循环利用的物质是____________________;滤渣Ⅱ与浓硫酸发生反应的化学方程式为__________________________________________________;已知(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”具体是指____________________ 过滤、洗涤、干燥。
(4) “分解”过程中产生的BeF2在熔融状态下不能导电,其电子式为_____________;“还原”过程可以用金属镁制备金属铍的原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三支体积相等的试管分别充满相同状态下气体:①氨气;②体积比为4:l的NO2和O2气体;③NO2气体;将他们分别倒立于盛有足量水的水槽中,液面恒定后(假设试管内液体不扩散),则下列结论正确的是( )
A.①和③试管内溶液体积不等,溶质物质的量浓度也不相等
B.因为它们都可溶于水,所以液面都上升到试管顶部
C.三支试管中,试管②中溶液中溶质的物质的量浓度最小
D.试管②和试管③中溶液的溶质的物质的量浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将7.68g铜与50mL一定浓度的硝酸恰好完全反应,收集到标准状况下4.48L气体。
请回答:
(1)NO的体积为__L,NO2的体积为__L;
(2)被还原的硝酸的物质的量是__mol;
(3)硝酸的物质的量浓度是__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是( )

A.图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为硫酸亚铁
B.原溶液中硫酸浓度为2.5 mol·L-1
C.原混合溶液中硝酸根离子的物质的量为0.2 mol
D.图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物C可用于制造高性能的现代通讯材料——光导纤维,C与烧碱反应生成化合物D。
(1)易与C发生化学反应的酸是________,反应的化学方程式是____________________。
(2)将C与纯碱混合高温熔融时发生化学反应生成D,同时还生成能使澄清石灰水变浑浊的氧化物E;将少量的E 通入D的水溶液中,生成化合物F。
①分别写出生成D和F的化学方程式:______________________________________
②要将纯碱高温熔化,下列坩埚中不可选用的是_______________________________。
A.普通玻璃坩埚
B.石英玻璃坩埚
C.铁坩埚
(3)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前很多工厂实现了烟气的脱硫脱硝和氨氮废水的无害化处理,回答下列问题:
(1)某小组同学在实验室里尝试模拟工厂处理氨氮废水(主要含NH![]() )的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH
)的不同方法,过程如下:①甲同学采用Ca(ClO)2作为氧化剂。将废水中的NH![]() 转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO
转化为无毒气体。他在实验中发现其他条件相同时,Ca(ClO)2的浓度越大碱性越强,处理后的废水中亚硝酸盐(NO![]() )的浓度也随之变大,写出该反应的离子方程式:___。
)的浓度也随之变大,写出该反应的离子方程式:___。
②乙同学在实验室模拟工业上的“吹脱法”测定废水的含氮量,设计了以下实验:精确称取wg废水样品,注入如所图示的仪器中,然后逐滴加入足量10%NaOH溶液,通入水蒸气。将样品液中的氨全部蒸出,用V1mLc1mol·L-1盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2molL-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
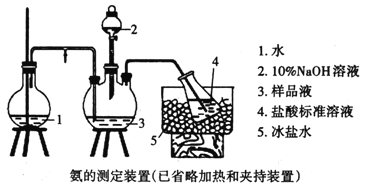
NH4Cl的电子式为___。盛放样品液的仪器是___(填名称);圆底烧瓶中长玻璃导管的作用是___;冰盐水的作用是___。
(2)某工厂利用NaClO2/(NH4)2CO3溶液脱除烟气中的SO2和NO。①保持溶液中NaClO2的浓度不变,研究(NH4)2CO3的浓度对NO和SO2脱除效率的影响[已知:(NH4)2CO3溶液显碱性;NaClO2的氧化性随pH增加而下降,酸性条件下会生成ClO2]。实验结果如图所示,随着(NH4)2CO3溶液浓度的增大造成NO脱除效率下降的主要原因是___。
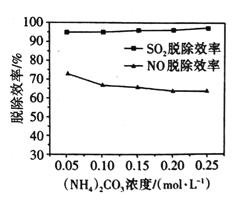
②NO脱除效率总是小于SO2脱除效率的主要原因是___。(写出一点)
(3)某工厂采用微生物硝化法处理氨氮废水,过程如图:
下列有关说法正确的是___(填标号)。
①微生物硝化法处理废水后会导致水体的pH升高
②若微生物保持活性的pH范围为7~9,则适宜用来调节水体pH的是CO2
③不能采用电解法在阴极将NH![]() 直接转化为NO
直接转化为NO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向一密闭容器中充入一定量的NH3,反应2NH3(g)![]() N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示。下列说法正确的是
N2(g)+3H2(g)达到平衡时N2的体积分数与温度、压强的关系如图所示。下列说法正确的是

A. 压强:p1>p2
B. b、c两点对应的平衡常数:Kc>Kb
C. a点:2v(NH3)正=3v(H2)逆
D. a点:NH3的转化率为1/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用H2C2O4(草酸)作助溶剂,酸浸提取硫酸烧渣(主要含Fe2O3、FeO、SiO2等)制备铁红并回收副产物硫酸铵的工艺流程如图:
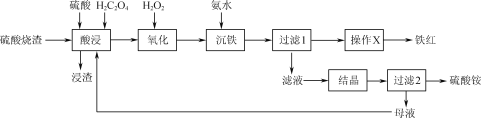
已知:H2C2O4可沉淀Ca2+、Fe2+等金属离子,可与Fe3+生成[Fe(C2O4)3]3-,在硫酸作用下可热分解生成CO和CO2。
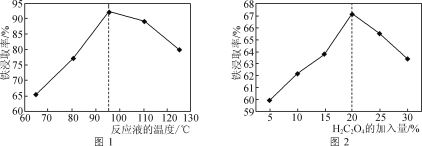
(1)用50%的硫酸“酸浸”时,反应液的温度、H2C2O4的加入量对铁浸取率的影响分别如图1、图2所示:
①“硫酸烧渣”中Fe2O3与H2SO4反应的化学方程式为___。
②图1中,反应液的温度高于95℃时,铁浸取率开始降低,其原因是___。
③图2中,H2C2O4加入量在5~20%时,铁浸取率随加入量的增大而增大,其原因是__;H2C2O4加入量超过20%时,铁浸取率反而开始降低,其原因是___。
(2)“沉铁”时发生的主要反应的离子方程式为____。
(3)由“过滤1”的滤渣制备铁红的“操作X”为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com