
【题目】(1)已知拆开1mol H—H键、1mol N—H键、1molN≡N键需要的能量分别是436 kJ、391 kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___。
(2)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,回答下列问题:
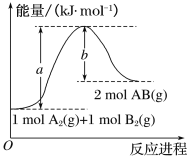
①该反应的ΔH___0(填“大于”“小于”或“等于”);
②反应物的总键能为__;
③写出该反应的热化学方程式____。
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l) ΔH1 ②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=___,联氨和N2O4可作为火箭推进剂的主要原因为____。
【答案】N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ·mol-1 大于 akJ·mol-1 A2(g)+B2(g)=2AB(g) ΔH=+(a-b)kJ·mol-1 2ΔH3-2ΔH2-ΔH1 反应放热量大、产生大量气体、无污染
【解析】
(1)焓变=反应物的总键能-生成物的总键能;
(2)①根据图示,反应物总能量小于生成物总能量;
②反应物的总键能是断开1mol A2(g)和1mol B2(g)吸收的总能量;
③焓变=反应物的总键能-生成物的总键能;
(3)根据盖斯定律,反应热只与反应体系的始态、终态有关,与反应历程无关。
(1)N2与H2反应生成NH3的化学方程式为N2(g)+3H2(g)=2NH3(g),该反应的ΔH=反应物的键能总和-生成物的键能总和= 946kJ/mol+3×436kJ/mol-6×391kJ/mol=-92kJ/mol;N2与H2反应生成NH3的热化学方程式为:N2(g)+3H2(g)=2NH3(g) ΔH=-92kJ/mol。
(2)①1mol A2(g)和1mol B2(g)具有的总能量小于2molAB(g)具有的总能量,反应A2(g)+B2(g)=2AB(g)为吸热反应,ΔH大于0。
②根据图象,反应物的总键能为akJ/mol。
③根据图象,该反应的ΔH=+(a-b)kJ/mol,该反应的热化学方程式为:A2(g)+B2(g)=2AB(g) ΔH=+(a-b)kJ/mol。
(3)根据盖斯定律,将③×2-①-②×2得2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g),则ΔH4=2ΔH3-ΔH1-2ΔH2。根据反应④知,联氨和N2O4作为火箭推进剂,反应放热量大、产生大量气体、无污染。


科目:高中化学 来源: 题型:
【题目】(1)用惰性电极电解下列溶液,写出电极反应式和总反应式以及溶液复原需加入的物质
①NaCl溶液
阴极:_________;阳极:_________;总反应式:_______________;溶液复原需加入的物质____________。
②CuSO4溶液
阴极:_________;阳极:______;总反应式:____________________________;溶液复原需加入的物质____________。
(2)写出下列原电池电极反应式和总反应式
①氢氧燃料电池(电解质是KOH溶液)
负极反应:______________________;
正极反应:__________________;
总反应:_____________。
②甲烷燃料电池。碱性介质(如KOH)
负极:____________;
正极:______________;
总反应式:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在处理胶片的废液中含有大量Ag+、Zn2+、Fe2+,某化学课外小组想从上述废液中回收银,并得到副产品硫酸亚铁,设计如下生产流程:
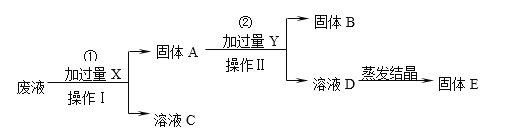
请回答:
⑴操作Ⅰ的名称是______,固体B的主要成分是______,X的化学式是______,Y的化学式是______。
⑵写出步骤②中反应的离子方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;
④将得到的产物熔融电解得到镁。
下列说法不正确的是( )
A. 此法的优点之一是原料来源丰富B. ①②③步骤的目的是从海水中提取镁盐
C. ①②③步骤涉及化合、分解和复分解反应D. 第①到第④步的反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂化和裂解过程得到的CH2=CH2,在一定条件下可以聚合成高分子化合物。含有![]() 结构的化合物与CH2=CH2一样,可在一定条件下聚合成高分子化合物。
结构的化合物与CH2=CH2一样,可在一定条件下聚合成高分子化合物。
(1)广泛用作农用薄膜的聚氯乙烯塑料,是由![]() 聚合成的,其化学方程式是____________。
聚合成的,其化学方程式是____________。
(2)电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯( ),它是由________________(写结构简式)聚合而成的。
),它是由________________(写结构简式)聚合而成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ag2SO4的Ksp=c2(Ag+)×c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,此时溶液中c(Ag+)=0.030mol·L-1。若t1时刻改变条件,下图中不正确的是( )
A. 加入100mL蒸馏水
加入100mL蒸馏水
B. 加入100mL0.010 mol·L-1AgSO4溶液
加入100mL0.010 mol·L-1AgSO4溶液
C. 加入100mL0.020mol·L-1Na2SO4溶液
加入100mL0.020mol·L-1Na2SO4溶液
D. 加入100mL0.040mol·L-1AgNO3溶液
加入100mL0.040mol·L-1AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
A.v(A)=0.5mol·L-1·min-1B.v(B)=1.2mol·L-1·s-1
C.v(D)=0.4mol·L-1·min-1D.v(C)=0.1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol·L-1,加入等体积0.3 mol·L-1的BaCl2溶液恰好使![]() 完全沉淀,则混合溶液中Na+的浓度为________。
完全沉淀,则混合溶液中Na+的浓度为________。
(2)将0.1 mol·L-1的K2SO4溶液、0.2 mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、![]() 的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
(3)在标准状况下,将一个充满HCl气体和氧气的集气瓶倒放于盛水的水槽中,水面上升至集气瓶容积的![]() ,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对化学和国防工业具有重要意义。
(1)实验室欲用下图所示装置(夹持固定装置略去)制备并收集氨气。

①请在图中烧瓶内绘出导管所缺部分______________。
②试管中反应的化学方程式是____________________。
③为吸收多余的氨气,烧杯中的试剂是__________________。
(2)氨有很多重要性质。
①将酚酞溶液滴加到氨水中溶液呈红色,其原因是_______________________________。
②管道工人曾经用浓氨水检验氯气管道是否漏气,如出现白烟,说明有氯气泄露,同时还有一种相对分子质量为28的气体生成,该反应的化学方程式是__________________________。
(3)写出氨的两种用途__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com