
【题目】对于可逆反应:A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
A.v(A)=0.5mol·L-1·min-1B.v(B)=1.2mol·L-1·s-1
C.v(D)=0.4mol·L-1·min-1D.v(C)=0.1mol·L-1·s-1
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl、![]()
B.甲基橙呈红色的溶液:![]() 、Ba2+、
、Ba2+、![]() 、Cl
、Cl
C.pH=12的溶液:K+、Na+、CH3COO、Br
D.使KSCN显血红色的溶液:![]() 、Mg2+、I、Cl
、Mg2+、I、Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知拆开1mol H—H键、1mol N—H键、1molN≡N键需要的能量分别是436 kJ、391 kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___。
(2)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,回答下列问题:
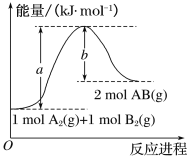
①该反应的ΔH___0(填“大于”“小于”或“等于”);
②反应物的总键能为__;
③写出该反应的热化学方程式____。
(3)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
①2O2(g)+N2(g)=N2O4(l) ΔH1 ②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=___,联氨和N2O4可作为火箭推进剂的主要原因为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:C(金刚石,s)+O2(g)=CO2(g) △H1 ;
C(石墨,s)+O2(g)=CO2(g) △H2;
C(石墨,s)=C(金刚石,s)△H3=+1.9kJ/mol 下列说法正确的是
A. 金刚石比石墨稳定 B. △H1 > △H2
C. △H3=△H1 -△H2 D. 石墨转化成金刚石的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,全国部分地区被雾霾笼罩,机动车尾气排放成为引发雾霾的罪魁祸首。提高空气质量,减少机动车尾气排放成为当务之急。汽车内燃机工作时引起反应:N2(g)+O2(g) ![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
断裂的共价键 | O =O | N≡N | N—O |
需要的能量 | 495 kJ·mol-1 | 945 kJ·mol-1 | 630 kJ·mol-1 |
(1)机动车发动机工作时会引发N2和O2的反应,该反应是____(填“放热”或“吸热”)反应,1 molO2与1 molN2的总能量比2 molNO的总能量___(填“大”或“小”)。
(2)N2与O2合成NO的热化学方程式可以表示为![]() N2(g)+
N2(g)+![]() O2(g)=NO(g)ΔH,则ΔH=_____。
O2(g)=NO(g)ΔH,则ΔH=_____。
(3)NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a___(填“增大”“减小”或“不变”)。
(4)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充满等物质的量的甲、乙两种气体,它们的温度和摩尔质量均相同。试根据甲、乙的密度(ρ)的关系,下列说法中正确的是
A. 若ρ(甲)>ρ(乙),则气体体积:甲<乙
B. 若ρ(甲)>ρ(乙),则分子数:甲>乙
C. 若ρ(甲)<ρ(乙),则气体摩尔体积:甲<乙
D. 若ρ(甲)<ρ(乙),则气体的压强:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇分子间脱水生成醚是制备简单醚的常用方法。用硫酸作为催化剂,在不同的温度下正丁醇和硫酸作用生成的产物会有不同,因此反应需严格控制温度。
主反应 ![]()
副反应 ![]()
主要实验装置如图所示
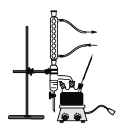
主要试剂及产物的部分性质如下表所示
名称 | 正丁醇 | 正丁醚 | 浓硫酸 |
相对分子质量 | 74 | 130 | 98 |
性状 | 无色液体 | 无色液体 | 无色液体 |
相对密度 | 0.8098 | 0.7689 | 1.84 |
沸点/℃ | 117.7 | 142.4 | 340 |
溶解度/(g/100ml水) | 7.7 | <0.5 |
实验步骤如下:
①在干燥的100mL三颈烧瓶中,放入14.8g正丁醇和4g(2.2mL)浓硫酸,摇动混合,并加入几粒沸石。按装置图,一瓶口装上温度计,温度计的水银球浸入液面以下。另一瓶口装上油水分离器(分水器),先在分水器中放置VmL水,然后将三颈烧瓶在电热套中加热,使瓶内液体微沸,开始回流。
②随反应的进行,分水器中液面增高,这是由于反应生成的水,以及未反应的正丁醇(在三颈烧瓶中会有二元或三元恒沸物)蒸出,经冷凝管冷凝后聚集于分水器内。继续加热到瓶内温度升高到135℃左右。分水器已全部被水充满时,表示反应已基本完成,约需1h。如继续加热,则溶液容易碳化变黑,并有大量副产物生成。
③反应物冷却后,把混合物连同分水器里的水一起倒入盛有一定量水的分液漏斗中,充分振荡,静置后,分出产物粗制正丁醚。用16mL5.0mol/L硫酸分2次洗涤,再用10mL水洗涤,然后加入无水氯化钙。将干燥后的产物注入蒸馏烧瓶中,收集139~142℃馏分,产量为5.6g。
请回答下列问题:
(1)在三颈烧瓶中加入几粒沸石,目的是____________。
(2)仪器a的名称是_____________。
(3)先在分水器中放置VmL水,已知分水器的容积为10mL,试计算VmL为_____mL(保留两位有效数字)。
(4)实验装置图中分水器的作用是________________________________。
(5)反应温度不易过高,溶液容易碳化变黑,并有大量副产物_____________生成。
(6)实验过程中需用5.0mol/L硫酸分2次洗涤正丁醚,用浓硫酸配制5.0mol/L硫酸溶液时,定容的操作方法为___________________________________。
(7)在③步骤中用10mL水洗涤的目的是_________。
(8)本实验最终获得5.6g正丁醚,则产率为_________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度和压强下,把装有NO和NO2的混合气体的试管倒立于水中,充分反应后,试管内气体的体积缩小为原气体体积的![]() ,则原混合气体中NO和NO2的体积比为( )
,则原混合气体中NO和NO2的体积比为( )
A. 3∶lB. 1∶3C. 2∶3D. 3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com