
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0mol/L的KNO3溶液:H+、Fe2+、Cl、![]()
B.甲基橙呈红色的溶液:![]() 、Ba2+、
、Ba2+、![]() 、Cl
、Cl
C.pH=12的溶液:K+、Na+、CH3COO、Br
D.使KSCN显血红色的溶液:![]() 、Mg2+、I、Cl
、Mg2+、I、Cl
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】已知2NO2(g) ![]() N2O4(g),在体积相同的A和B两个带活塞的玻璃容器中,如分别注入1/4容积颜色相同的NO2和Br2(气),然后将活塞同时向外拉到1/2处(快速),过一会儿可以看到
N2O4(g),在体积相同的A和B两个带活塞的玻璃容器中,如分别注入1/4容积颜色相同的NO2和Br2(气),然后将活塞同时向外拉到1/2处(快速),过一会儿可以看到
A.A中颜色比B中浅B.A中颜色比B中深
C.A、B中颜色深浅一样D.A、B中颜色都比开始时深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关叙述中,不正确的是( )
A.CH4中心原子的杂化轨道类型为sp3杂化
B.以非极性键结合起来的双原子分子一定是非极性分子
C.氯化钠晶体中,Na+和Cl-的配位数均为8
D.镍元素基态原子的电子排布式为:1s22s22p63s23p63d84s2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在处理胶片的废液中含有大量Ag+、Zn2+、Fe2+,某化学课外小组想从上述废液中回收银,并得到副产品硫酸亚铁,设计如下生产流程:
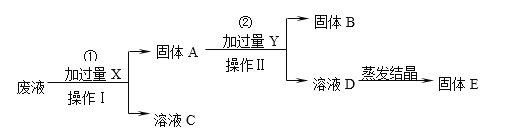
请回答:
⑴操作Ⅰ的名称是______,固体B的主要成分是______,X的化学式是______,Y的化学式是______。
⑵写出步骤②中反应的离子方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A.用惰性电极电解CuCl2溶液:Cu2++2Cl-+2H2O![]() Cu(OH)2↓+H2↑+Cl2↑
Cu(OH)2↓+H2↑+Cl2↑
B.向FeBr2溶液中通入过量Cl2:2Fe2++4Br﹣+2Cl2=2Fe3++2Br2+4Cl﹣
C.向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++ SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
D.NH4HCO3溶液与过量NaOH溶液反应:NH4+ +OH﹣=NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;
④将得到的产物熔融电解得到镁。
下列说法不正确的是( )
A. 此法的优点之一是原料来源丰富B. ①②③步骤的目的是从海水中提取镁盐
C. ①②③步骤涉及化合、分解和复分解反应D. 第①到第④步的反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂化和裂解过程得到的CH2=CH2,在一定条件下可以聚合成高分子化合物。含有![]() 结构的化合物与CH2=CH2一样,可在一定条件下聚合成高分子化合物。
结构的化合物与CH2=CH2一样,可在一定条件下聚合成高分子化合物。
(1)广泛用作农用薄膜的聚氯乙烯塑料,是由![]() 聚合成的,其化学方程式是____________。
聚合成的,其化学方程式是____________。
(2)电器包装中大量使用的泡沫塑料的主要成分是聚苯乙烯( ),它是由________________(写结构简式)聚合而成的。
),它是由________________(写结构简式)聚合而成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
A.v(A)=0.5mol·L-1·min-1B.v(B)=1.2mol·L-1·s-1
C.v(D)=0.4mol·L-1·min-1D.v(C)=0.1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被誉为“21世纪的金属”,可呈现多种化合价,其中以+4价的Ti最为稳定。回答下列问题:
(1)基态Ti原子的价电子轨道表示式为 ___。
(2)已知电离能:I2(Ti)=1 310 kJ/mol,I2(K)=3051 kJ/mol,I2(Ti)<I2(K),其原因为_____________
(3)钛某配合物可用于催化环烯烃聚合,其结构如下图所示:
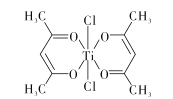
①钛的配位数为 ___,碳原子的杂化类型____。
②该配合物中存在的化学键有____(填字母代号)。
A.离子键 B.配位键 C.金属键 D.共价键 e.氢键
(4)钛与卤素形成的化合物熔沸点如下表所示:
TiCl4 | TiBr4 | TiI4 | |
熔点/℃ | -24.1 | 38.3 | 155 |
沸点/℃ | 136.5 | 233.5 | 377 |
分析TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是_________________
(5)已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子化学式为____,阴离子的空间构型为__________ .
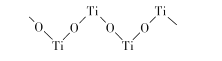
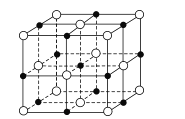
(6)已知TiN晶体的晶胞结构如图所示,若该晶胞的密度为ρg/cm3,阿伏加德罗常数值为NA,则晶胞中Ti原子与N原子的最近距离为____pm(用含p、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com