
【题目】近年来,全国部分地区被雾霾笼罩,机动车尾气排放成为引发雾霾的罪魁祸首。提高空气质量,减少机动车尾气排放成为当务之急。汽车内燃机工作时引起反应:N2(g)+O2(g) ![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
2NO(g),是导致汽车尾气中含有NO的原因之一。已知断裂某些共价键需要的能量如表:
断裂的共价键 | O =O | N≡N | N—O |
需要的能量 | 495 kJ·mol-1 | 945 kJ·mol-1 | 630 kJ·mol-1 |
(1)机动车发动机工作时会引发N2和O2的反应,该反应是____(填“放热”或“吸热”)反应,1 molO2与1 molN2的总能量比2 molNO的总能量___(填“大”或“小”)。
(2)N2与O2合成NO的热化学方程式可以表示为![]() N2(g)+
N2(g)+![]() O2(g)=NO(g)ΔH,则ΔH=_____。
O2(g)=NO(g)ΔH,则ΔH=_____。
(3)NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)=2CO2(g)+N2(g) ΔH=a kJ·mol-1,但该反应的速率很小,若使用机动车尾气催化转化器,尾气中的NO与CO可以转化成无害物质排出。上述反应在使用“催化转化器”后,a___(填“增大”“减小”或“不变”)。
(4)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
O2(g)=FeO(s) ΔH1=-275.0 kJ·mol-1;
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
O2(g)=Al2O3(s) ΔH2=-1 675.0 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是_______。
【答案】吸热 小 +90 kJ·mol-1 不变 2Al(s)+3FeO(s) =Al2O3(s)+3Fe(s) ΔH=-850 kJ·mol-1
【解析】
(1)根据图示数据,结合焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,计算判断;
(2)根据焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算解答;
(3)催化剂只能改变反应的速率,不能改变反应热的大小;
(4)根据盖斯定律分析解答。
(1)焓变ΔH=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,根据图示数据可知,N2+O2═2NO,△H=945kJ/mol+495kJ/mol-2×630kJ/mol=+180kJ/mol>0,是吸热反应,反应物的总能量小于生成物的总能量,即1molO2与1molN2的总能量比2molNO的总能量小,故答案为:吸热;小;
(2)N2+O2═2NO,△H=945kJ/mol+495kJ/mol-2×630kJ/mol=+180kJ/mol,则![]() N2(g)+
N2(g)+![]() O2(g)═NO(g)的△H=
O2(g)═NO(g)的△H=![]() ×(+180kJ/mol)=+90kJ/mol,故答案为:+90kJ/mol;
×(+180kJ/mol)=+90kJ/mol,故答案为:+90kJ/mol;
(3)催化剂只改变反应速率,不改变化学平衡,不改变反应的反应热,所以2NO(g)+2CO(g)2CO2(g)+N2(g)△H=akJmol-1,使用机动车尾气催化转化器,a值不变,故答案为:不变;
(4)①Fe(s)+![]() O2(g)=FeO(s)△H=-275.0kJmol-1,②2Al(s)+
O2(g)=FeO(s)△H=-275.0kJmol-1,②2Al(s)+![]() O2(g)=Al2O3(s)△H=-1675.0kJmol-1,由盖斯定律②-①×3计算得到:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-850kJ/mol,故答案为:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-850kJ/mol。
O2(g)=Al2O3(s)△H=-1675.0kJmol-1,由盖斯定律②-①×3计算得到:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-850kJ/mol,故答案为:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-850kJ/mol。


科目:高中化学 来源: 题型:
【题目】室温下,下列有关结论正确的是( )
A.向稀醋酸中加水稀释使电离程度增大,溶液pH减小
B.将CH3COONa溶液从20℃升温至30℃,![]() 溶液中增大
溶液中增大
C.向0.1mol·L-1的NaHSO3溶液中加入氨水至中性,则c(Na+)+c(NH![]() )=2c(SO
)=2c(SO![]() )+c(HSO
)+c(HSO![]() )
)
D.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH<7,则H2A是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳;
②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;
③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;
④将得到的产物熔融电解得到镁。
下列说法不正确的是( )
A. 此法的优点之一是原料来源丰富B. ①②③步骤的目的是从海水中提取镁盐
C. ①②③步骤涉及化合、分解和复分解反应D. 第①到第④步的反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ag2SO4的Ksp=c2(Ag+)×c(SO42-)=1.4×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,此时溶液中c(Ag+)=0.030mol·L-1。若t1时刻改变条件,下图中不正确的是( )
A. 加入100mL蒸馏水
加入100mL蒸馏水
B. 加入100mL0.010 mol·L-1AgSO4溶液
加入100mL0.010 mol·L-1AgSO4溶液
C. 加入100mL0.020mol·L-1Na2SO4溶液
加入100mL0.020mol·L-1Na2SO4溶液
D. 加入100mL0.040mol·L-1AgNO3溶液
加入100mL0.040mol·L-1AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:A(g)+3B(s)![]() 2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
2C(g)+2D(g),在不同条件下的反应速率如下,其中表示的反应速率最大的是( )
A.v(A)=0.5mol·L-1·min-1B.v(B)=1.2mol·L-1·s-1
C.v(D)=0.4mol·L-1·min-1D.v(C)=0.1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年5月5日晚18时00分,我国载人空间站货物返回舱试验舱在我国文昌航天发射场点火升空, 5月8日飞船试验船返回舱在东风着陆场预定区域成功着陆,试验取得圆满成功。金属铍(Be)是火箭、航空、宇宙航行的重要材料,工业上以含铍废渣(主要成分是Be和MgF2)为原料制备金属铍的工艺流程如图:

已知:MgF2和CaF2难溶于水。回答下列问题:
(1)提高浸出速率的方法有________、_______(任写两项);已知滤液Ⅰ中铍元素的存在形式为H2BeF4,写出“浸出”过程中发生反应的化学方程式:____________。
(2)过滤所得滤渣I的主要成分为________(填化学式)。
(3)该流程中可循环利用的物质是____________________;滤渣Ⅱ与浓硫酸发生反应的化学方程式为__________________________________________________;已知(NH4)2BeF4易溶于水,且其在水中的溶解度随温度的升高而大幅度增大,从NH4F与滤液Ⅱ发生反应后所得溶液中获得(NH4)2BeF4晶体的“一系列操作”具体是指____________________ 过滤、洗涤、干燥。
(4) “分解”过程中产生的BeF2在熔融状态下不能导电,其电子式为_____________;“还原”过程可以用金属镁制备金属铍的原因是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1 mol·L-1,加入等体积0.3 mol·L-1的BaCl2溶液恰好使![]() 完全沉淀,则混合溶液中Na+的浓度为________。
完全沉淀,则混合溶液中Na+的浓度为________。
(2)将0.1 mol·L-1的K2SO4溶液、0.2 mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合液中K+、Al3+、![]() 的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
的浓度分别为0.1 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则K2SO4溶液、Al2(SO4)3溶液、纯水三者的体积比________(忽略体积的变化)。
(3)在标准状况下,将一个充满HCl气体和氧气的集气瓶倒放于盛水的水槽中,水面上升至集气瓶容积的![]() ,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
,把集气瓶从水中取出(假设HCl全部留在集气瓶中),若溶液密度的变化忽略不计,则HCl的物质的量浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用惰性电极电解CuSO4溶液(如图的装置),
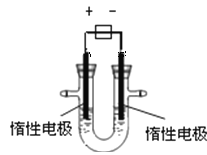
该过程中电解池电极反应式为是阳极: , 阴极: 。
(2)若电解池中装入足量溶液,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为 (假设气体全部逸出)。
(3)欲使电解液恢复到起始状态,应向溶液中加入适量的
A.CuSO4 B.H2O C.CuO D.CuSO4·5H2O
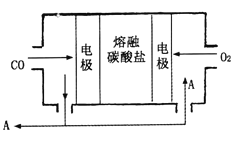
(4)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破。该电池示意图如右:负极电极反应式为_________________________,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环。A物质的化学式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果不正确的是( )

A.图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为硫酸亚铁
B.原溶液中硫酸浓度为2.5 mol·L-1
C.原混合溶液中硝酸根离子的物质的量为0.2 mol
D.图中,OA段产生的气体是一氧化氮,BC段产生的气体是氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com