
【题目】下列关于热化学反应的描述中正确的是
A.有氧气参与的反应都是放热反应
B.热化学方程式既表示能量的变化,又表示物质的变化
C.若2CO2(g)![]() 2CO(g)+O2(g)△H=+566kJ·mol-1,则CO的燃烧热△H=-566 kJ·mol-1
2CO(g)+O2(g)△H=+566kJ·mol-1,则CO的燃烧热△H=-566 kJ·mol-1
D.放热反应理论上都可以设计为原电池,将化学能转化为电能
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,含有少量氧化铁,利用明矾石制备K2SO4的工艺流程如图所示:

据此流程图回答下列问题:
(1)①焙烧炉中Al2(SO4)3与S反应的产物是两种氧化物,该反应的化学方程式为______;写出炉气的一种用途________。
(2)②中Al2O3参与反应的离子方程式为__________。
(3)③中调节pH不能用CO2的理由是____________________。
(4)工业冶炼金属铝需要定期更换补充阳极碳块的原因是__________________。
(5)纯净氢氧化铝经历两次__________________(填反应类型)可制得铝。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池负极的电极反应式是__________________。
(6)现有明矾石1 625 t,按上述流程制得780 t Al(OH)3,忽略铝元素的损失,请计算明矾石中钾元素的质量分数为____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氢气和水,反应方程式可表示为:2NH3(g)+NO(g)+NO2(g)![]() 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
(1)一定条件下,在容积为2L的容器内进行该反应,20min时达到平衡,生成N2 0.4mol,则平均反应速率v(NO)=___________________。可从混合气体的颜色变化判断上述反应是否达到平衡,其理由是_______________________________________________。
(2)工业上也用氨水吸收SO2尾气,最终得到(NH4)2SO4,(NH4)2SO4溶液中c(NH4+)与c(SO42-)之比____2:1(选填“>”、“<”、“=”),用离子方程式解释其原因______________________。
(3)与Cl2相比较,ClO2处理水时被还原成Cl-,不生成有机氯代物等有害物质。工业上可用亚铝酸钠和稀盐酸为原料制备ClO2,反应如下:NaClO2+HCl→ClO2↑+NaCl+_____(没有配平)
(4)补全方程式并配平,标出电子转移方向和数目_________________________ 。
(5)该反应中氧化剂和还原剂的物质的量之比是___________。若生成0.2molClO2,转移电子数为_____个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷和Cl2(g)反应的能量关系如图所示。下列叙述正确的是
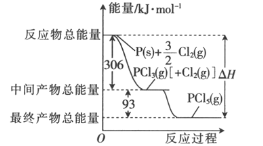
A.PCl5(g)比PCl3(g)稳定B.加入催化剂不会改变△H的大小
C.整个过程吸收的能量为399kJD.PCl3(g)的燃烧热△H=-93kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿托酸是一种常用的医药中间体,其结构如图所示,下列有关说法正确的是( )
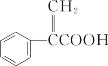
A.阿托酸的分子式为C9H6O2
B.阿托酸分子中所有原子可能处于同一平面
C.在一定条件下,1mol阿托酸最多能和5molH2发生反应
D.阿托酸能发生取代、加成、水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烷基烯酮二聚体(AKD)是造纸工业上常用的一种浆内施胶剂,其结构简式如图所示,下列说法正确的是( )
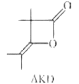
A.AKD的分子式为C8H14O2
B.AKD与NaOH溶液能发生皂化反应
C.AKD分子中所有碳原子处于同一平面
D.AKD能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol·L-1的盐酸分别滴定20.00mL 0.1000mol·L-1氨水和20.00mL 0.1000mol·L-1 NaOH溶液,滴定曲线如图所示。下列说法不正确的是
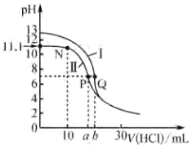
A.25℃,Kb(NH3·H2O)的数量级为10-5
B.N点处的溶液中:c(NH![]() )>c(NH3·H2O)
)>c(NH3·H2O)
C.曲线II滴定终点时所选的指示剂为酚酞
D.Q点所加盐酸的体积为b mL,则b=20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计实验制备NaHSO2·HCHO·2H2O[次硫酸氢钠甲醛(雕白块)]。回答下列问题:
⑴甲同学用下列装置制备实验原料Na2S2O5(焦亚硫酸钠),装置如图:

已知pH=4.1的过饱和NaHSO3溶液能自动脱水生成Na2S2O5。
①通入H2的目的是___。
②通入SO2发生反应的化学方程式依次为___、___和2NaHSO3=Na2S2O5↓十H2O。
③从环境保护和安全考虑,尾气处理方法正确的是___ (填字母)。
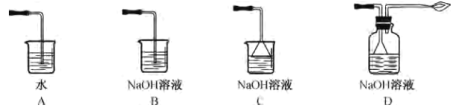
④实验若用稀NaOH溶液,则不能制得Na2S2O5,其原因是___。
⑵乙同学用甲同学制得的Na2S2O5通过下列装置(夹持装置已略)合成雕白块。
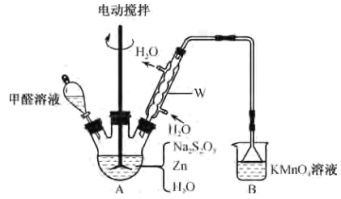
①仪器W的名称是___。
②合成反应温度需保持在75℃,采用的合适加热方式是___,已知反应中Zn转化为ZnO和Zn(OH)2,三口烧瓶中发生反应的化学方程式为___。
③三口烧瓶中的反应液需经过过滤、___、过滤、洗涤及干燥,得雕白块。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物(NOx)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如下图所示。
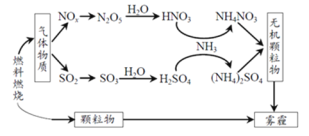
(1)NH3 的电子式是______。
(2)NH4NO3 溶液中的离子浓度由大到小顺序是_____。
(3)①已知:SO2 生成 SO3 总反应方程式是:2SO2(g)+O2(g)2SO3(g)。此反应可通过如下两步完成:2NO(g)+O2 (g ) 2NO2(g),写出第二步的化学方程式______。
②一定温度下,向 2 L 恒容密闭容器中充入 NO2 和 SO2 各 1 mol,5min 达到平衡,此时容器中 NO2 和
NO 的浓度之比为 1∶3,则 NO2 的平衡转化率是_____。
(4)利用NaClO2/H2O2 酸性复合吸收剂可同时有效脱硫、脱硝。
①制备少量NaClO2,其装置如下图所示:
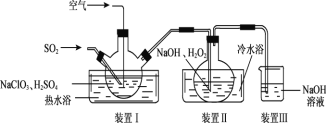
装置 I 控制温度在 35~55℃,通入 SO2 将 NaClO3 还原为 ClO2(沸点:11℃),反应的离子方程式是_____,装置 Ⅱ中反应生成NaClO2,此反应中作为氧化剂的是___,反应后装置Ⅲ中溶液中阴离子除了 ![]() 、
、![]() 、Cl-、ClO-、OH-外还可能含有的一种阴离子是_____。
、Cl-、ClO-、OH-外还可能含有的一种阴离子是_____。
②用制得的NaClO2/H2O2 酸性复合吸收剂同时对 NO、SO2 进行氧化得到硝酸和硫酸而除去。在温度一定时,n(H2O2)/n(NaClO2)、溶液 pH 对脱硫脱硝的影响如下图所示:
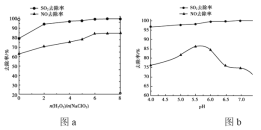
从图 a 和图 b 中可知脱硫脱硝最佳条件是 ______。图 b 中SO2 的去除率随 pH 的增大而增大,而NO 的去除率在 pH>5.5 时反而减小,请解释 NO 去除率减小的可能原因是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com