
【题目】用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
A. AgNO3 B. NaCl C. CuCl2 D. H2SO4
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】 反应其△H= -122 kJ·mol-1,S=231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是

A. 可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
B. 足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O==2HIO3+10HCl
C. 由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D. 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ι)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(2)某同学把新制的氯水加到NaNO2溶液中,请写出反应的离子方程式:________________。
(3)铝能溶解在碱性亚硝酸盐溶液中,生成能使湿润的红色石蕊变蓝的气体,请写出反应的离子方程式__________________;
(Ⅱ)某暗紫色化合物A在常温和干燥的条件下,可以稳定存在,但它在水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验。经组成分析,该粉末仅含有O、K、Fe三种元素。另取3.96g化合物A的粉末溶于水,滴加足量稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。
下列物质中有可能提高化合物A水溶液稳定性的是 。
A.醋酸钠 B.醋酸 C.Fe(NO3)3 D.KOH
(2)请设计一个实验方案,研究温度对化合物A溶液稳定性的影响
(3)下图表示足量 Fe粉还原KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式:
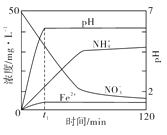
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.容器②中达平衡时放出的热量Q=23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式是一种重要的化学用语。所写的化学方程式不能用来正确解释化学过程或事实的是
A.熔融烧碱时不能使用石英坩埚:SiO2+2NaOH![]() Na2SiO3 + H2O
Na2SiO3 + H2O
B.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+3H2O2+2H+ →I2 +O2↑+4H2O
C.红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
D.“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:
ClO-+Cl-+2H+→Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由水电离出来的氢离子浓度为10-13 mol/L,在此溶液中一定能大量共存的离子组是
A. ClO—、K+、Cl— B. Ba2+、Na+、Br—
C. Na+、Fe3+、SO42— D. K+、NO3—、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
I.根据下列物质的名称(俗名)写出相应的化学式。
(1) 二氧化碳: ;(2) 硫粉: ;(3) 亚硫酸: ;
(4) 氢氧化钙: ;(5) 纯碱: ;(6) 氧化铝: 。
II.根据下列反应写出相应的化学方程式。
(7) 稀盐酸与CaCO3反应: ;
(8) 制作Fe(OH)3胶体: 。
III.现有三种可加热的仪器:①试管;②烧杯;③蒸发皿。
(9) 其中能够直接加热的是(填序号): ;
(10)仪器①在加热固体时,试管口应 ;仪器③在蒸发实验中,所加液体体积不超过容积的 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g) ![]() 2Z(g)若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达 平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是
2Z(g)若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),当达 平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是
A.c1:c2=1:3
B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.c1的取值范围为0<c1<0.14 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com