
【题目】 反应其△H= -122 kJ·mol-1,S=231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列图像中的曲线(纵坐标为沉淀或气体的量,横坐标为加入物质的量)错误是
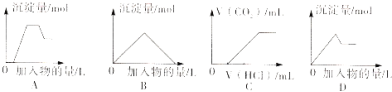
A.图A表示向含H+、Mg2+、Al3+、NH4+的溶液中滴加NaOH溶液产生沉淀摄的关系曲线
B.图B表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C.图C表示向NaOH和Na2CO3的混合液中滴加盐酸产生CO2气体的关系曲线
D.图D表示向明矾溶液中滴加Ba(OH)2溶液产生沉淀最的关系曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f六种短周期元素,原子序数依次增大,有关信息如下。

请回答下列问题:
(1)f元素在周期表中的位置为:____________________________。
(2)上述六种元素中,原子半径最大的是(写元素符号)__________。
(3)请写出能证明f元素的非金属性比S元素的非金属性强的化学方程式:_________________。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为____________________________。
物质M中存在的化学键类型为______________________
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗lL1.8mol·L-1NaOH溶液和16.8LO2(体积已换算成标准状况),则两种气体的分子式及物质的量分别为__________、___________,生成硫酸铜物质的量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知甲、乙、丙三种物质均含有同种元素X,其转化关系如下:
![]()
下列说法不正确的
A.若A为NaOH溶液,乙为白色沉淀,则X可能为短周期金属元素
B.若乙为NaHCO3,则甲或丙可能是CO2
C.若A为硝酸,X为金属元素,则甲与乙反应可生成丙
D.若A为氧气,丙在通常状况下为红棕色气体,则甲可能为非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(a)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
(1)将2.0mol SO2和1.0molO2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数等于___________。
(2)若改在容器中加入1.0 mol SO2、0.5mol O2和amol SO3,保持温度不变反应达平衡后,体系总压强也为0.10MPa,则a=_________mol。SO2的平衡转化率为_________________。
(3)平衡状态由A变到B时,平衡常数K(A)____ ______K(B)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.糖类、油脂、蛋白质都能发生水解反应
B.油脂、蛋白质都是由C、H、O三种元素组成
C.糖类、油脂、蛋白质都是高分子化合物
D.油脂有油和脂肪之分,在分类上都属于酯类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
(ⅰ)I2(g)+H2(g)![]() 2HI(g) ΔH=-9.48 kJ·mol-1
2HI(g) ΔH=-9.48 kJ·mol-1
(ⅱ)I2(s)+H2(g)![]() 2HI(g) ΔH=+26.48 kJ·mol-1
2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是
A.1 mol I2(s)中通入2 g H2(g),反应吸热26.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低
D.反应(ⅰ)放出的热量多,所以产物的能量低,比反应(ⅱ)的产物更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是
A. AgNO3 B. NaCl C. CuCl2 D. H2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com