
【题目】a、b、c、d、e、f六种短周期元素,原子序数依次增大,有关信息如下。

请回答下列问题:
(1)f元素在周期表中的位置为:____________________________。
(2)上述六种元素中,原子半径最大的是(写元素符号)__________。
(3)请写出能证明f元素的非金属性比S元素的非金属性强的化学方程式:_________________。
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为____________________________。
物质M中存在的化学键类型为______________________
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗lL1.8mol·L-1NaOH溶液和16.8LO2(体积已换算成标准状况),则两种气体的分子式及物质的量分别为__________、___________,生成硫酸铜物质的量为_______________。
【答案】(1)第3周期第ⅦA族
(2)Na
(3)Na2S+Cl2=2NaCl+S↓或H2S+Cl2=2HCl+S↓
(4)3NH3+3H2O+Al3+=Al(OH)3↓+3NH4+离子键、共价键
(5)NO0.6mol,NO21.2mol1.5mol
【解析】试题分析:a的单质为密度最小的气体,可知a为H;N元素的最高价氧化物的水化物HNO3可与NH3反应生成离子型化合物NH4NO3,故b为N;地壳中含量最多的元素为O,c为O;钠须保存在煤油中,d为Na;第三周期简单离子的半径最小的是Al3+,则e为Al;氯的最外层为7个电子,比次外层8电子少一个,故f为Cl;
(1)氯的核电荷数为17,此元素在周期表中的位置为第3周期第ⅦA族;
(2)上述六种元素中,原子半径最大的是第三周期的Na;
(3)根据反应Na2S+Cl2=2NaCl+S↓或H2S+Cl2=2HCl+S↓可知氯的氧化性比S强,即Cl的非金属性比S强;
(4)M是仅含非金属元素的盐应为NH4NO3,结合上述6种元素,可知是在Al(NO3)3溶液中通入NH3;
发生反应的离子方程式为3NH3+3H2O+Al3+=Al(OH)3↓+3NH4+;NH4NO3中存在的化学键类型为离子键、共价键;
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生产的盐只有硫酸铜,同时生成的两种气体由两种元素组成,气体的相对分子质量都小于50,应为二氧化氮和一氧化氮,16.8L氧气的物质的量为0.75mol,
0.75mol氧气参与反应转移电子的物质的量为0.75mol×4=3mol,生成的最高价含氧酸盐为NaNO3,
假设二氧化氮的物质的量为xmol,NO的物质的量为ymol,则:x+y=lL×1.8mol·L-1,x+3y=3,解得:x=1.2mol,y=0.6mol;根据电子守恒,参与反应的Cu的物质的量为n(Cu)=3mol÷2=1.5mol;可知生成的CuSO4为1.5mol。


科目:高中化学 来源: 题型:
【题目】可逆反应∶2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是
2NO+O2在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2 的同时,生成2n mol NO ③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥ 混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C.①③④ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,向一带活塞的密闭容器中充入2molA和1molB,发生下列反应:2A(g)+B(g)![]() 2C(g) △H< 0,达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图。下列对t1时刻改变条件的推测中正确的是
2C(g) △H< 0,达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图。下列对t1时刻改变条件的推测中正确的是
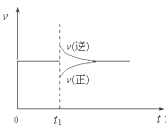
A、保持压强不变,升高反应温度
B、保持温度不变,增大容器体积
C、保持温度和容器体积不变,充入1molC(g)
D、保持温度和压强不变,充入1molC(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的NH4Fe(SO4)2溶液中,下列各组离子能大量共存的是
A. H+、Ba2+、Br-、I- B. K+、Na+、CO32-、OH-
C. Cu2+、Al3+、Cl-、NO3- D. Ca2+、Mg2+、CH3COO-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法中,正确的是
①常温下,15g甲醛(![]() )中含有的共用电子对总数为2NA
)中含有的共用电子对总数为2NA
②常温常压下,18gD2O中含有的电子总数为10NA
③将l00mL0.1mol·L-1的FeCl3溶液滴入沸水中,可制得Fe(OH)3胶粒0.0lNA.
④在反应KIO3+6HI===KI+3I2+3H2O中,每生成3molI2转移的电子数为5NA
⑤电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜
⑥1.7g的羟基与1.7g的氢氧根离子所含电子数均为0.9NA
A.①④
B.③④
C.②⑥
D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 反应其△H= -122 kJ·mol-1,S=231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种粒子之间有如图所示关系,根据图示转化关系推测下列说法不正确的是

A. 可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
B. 足量Cl2能使湿润的KI淀粉试纸变白的原因可能是5Cl2+I2+6H2O==2HIO3+10HCl
C. 由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D. 途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com