



科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
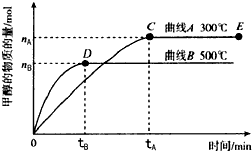
| A、平衡常数K(300℃)小于K(500℃) | ||
| B、在其他条件下不变时,压缩处于E点的体系体积,甲醇浓度增大 | ||
| C、300℃,当容器内气体密度不变时说明反应已经达到平衡 | ||
D、500℃,从反应开始到平衡,氨气的平均反应速率v(H2)=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y是地壳中含量最多的元素 |
| B、非金属性:X>Y |
| C、X、Y同主族,Y、Z同周期 |
| D、高熔点的氧化物是M |
查看答案和解析>>
科目:高中化学 来源: 题型:
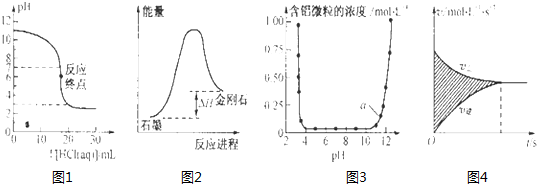
| A、图1表示0.001mol?L-1盐酸滴定0.001mol?L-1NaOH溶液的滴定曲线 |
| B、图2所示,从能量角度考虑,石墨比金刚石稳定 |
| C、图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存Al3+ |
| D、图4所示,图中的阴影部分面积的含义是[v(正)-v (逆)] |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com