
【题目】一同学欲从量筒中取出部分液体,他先俯视凹液面的最低处,读数为50mL,倒出液体后,他又仰视凹液面的最低处,读数为10mL他实际倒出液体的体积为
A. 40mL B. 大于40mL C. 小于40mL D. 不一定
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】把含硫酸铵和硝酸铵的混合液a L分成两等份.一份加入含b mol NaOH的溶液并加热,恰好把NH3全部赶出;另一份需消耗c mol BaCl2才能使SO42﹣完全沉淀,则原溶液中NO3﹣的物质的量浓度为( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G是一种医药中间体,常用于制备抗凝血药。可以通过如下所示的合成路线合成有机物G。

已知:
①
②
请回答下列问题:
(1)写出A中官能团的名称:___________________。
(2)D的结构简式:____________________________。
(3)写出B![]() C的化学反应方程式:_______________________________。
C的化学反应方程式:_______________________________。
(4)下列说法正确的是_____________(不定项)。
A.有机物G的分子式为C9H8O3 B.F能使酸性KMnO4溶液褪色
C.甲酸甲酯与C互为同分异构体 D.有机物A、B、C均能溶解于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烯烃、炔烃的叙述中,正确的是
A. 某物质的名称为2-乙基-1-丁烯,它的结构简式为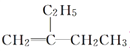
B. CH3—CH===CH—C≡C—CF3分子结构中6个碳原子可能都在一条直线上
C. 相同物质的量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的量相同
D. β—月桂烯的结构如图![]() 所示,该物质与等物质的量溴发生加成反应的产物(不考虑立体异构)理论上最多有5种
所示,该物质与等物质的量溴发生加成反应的产物(不考虑立体异构)理论上最多有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.15g甲基(﹣CH3)所含有的电子数是10 NA个
B.标准状况下,2.24 L CHCl3的原子总数为0.5 NA个
C.4.2g C3H6中含有的碳碳双键数一定为0.1NA
D.常温下,14g乙烯和丙烯的混合物中总原子数为3NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分.
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为 .
(2)表中元素原子半径最大的是(写元素符号) .
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是 .
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1mol X的最高价化合物,恢复至室温,放热687kJ.已知该化合物的熔、沸点分别为﹣69℃和58℃.写出该反应的热化学方程式: .
(5)碳与镁生成的1mol化合物Q与水反应生成2mol Mg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为 . Q与水反应的化学方程式为 .
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2molL﹣1 NaOH溶液和1mol O2 , 则两种气体的分子式及物质的量分别为 , 生成硫酸铜物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电化学装置如图所示,电极I为Al,其它均为Cu,且开始时四电极质量均相等,下列叙述正确的是( ) 
A.甲为原电池,乙、丙均为电解池
B.电子流动方向:电极Ⅳ→A→电极I
C.当0.1mol电子转移时,电极I和电极Ⅳ的质量差为4.1g
D.若丙中的电解质改为CuCl2 , 电极Ⅲ的电极反应发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mgL﹣1 . 我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mgL﹣1 . 某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO.
Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH﹣═2MnO(OH)2↓
酸性条件下,MnO(OH)2将I﹣氧化为I2:②MnO(OH)2+I﹣+H+→Mn2++I2+H2O(未配平)
用Na2S2O3标准溶液滴定生成的I2;③2S2O32﹣+I2═S4O62﹣+2I﹣
Ⅱ.测定步骤:
a.安装装置,检验气密性,充N2排尽空气后,停止充N2 .
b.向烧瓶中加入200mL水样.
c.向烧瓶中依次迅速加入1mL MnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量)开启搅拌器,至反应①完全.
d.搅拌并向烧瓶中加入2mL H2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性.
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000molL﹣1 Na2S2O3溶液进行滴定,记录数据.f…
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化).
回答下列问题:
(1)配制以上无氧溶液时,除去所用溶剂水中氧的简单操作为 .
(2)在橡胶塞处加入水样及有关试剂应选择的仪器是 .
①滴定管 ②注射器 ③量筒
(3)搅拌的作用是 .
(4)配平反应②的方程式,其化学计量数依次为 .
(5)步骤f为 .
(6)步骤e中达到滴定终点的标志为 . 若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=mgL﹣1(保留一位小数).作为饮用水源,此次测得DO是否达标:(填“是”或“否”)
(7)步骤d中加入H2SO4溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂.实验室采用镁屑与液溴为原料制备无水MgBr2 , 装置如图1,主要步骤如下:
步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴.
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中.
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚溴化镁粗品.
步骤4 室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品.
已知:①Mg与Br2反应剧烈放热;MgBr2具有强吸水性.
②MgBr2+3C2H5OC2H5MgBr23C2H5OC2H5
请回答:
(1)仪器A的名称是 . 实验中不能用干燥空气代替干燥N2 , 原因是 .
(2)如将装置B改为装置C(图2),可能会导致的后果是 .
(3)步骤3中,第一次过滤除去的物质是 .
(4)有关步骤4的说法,正确的是 .
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:
Mg2++Y4﹣═MgY2﹣
①滴定前润洗滴定管的操作方法是 .
②测定时,先称取0.2500g无水MgBr2产品,溶解后,用0.0500molL﹣1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是(以质量分数表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com