
【题目】下列离子不能大量共存于同一溶液中的是
A. NH4+、NO3-、Fe2+、H+ B. NO3-、Na+、Ba2+、Ag+
C. C1-、Cu2+、SO42-、NO3- D. SO42-、NO3-、K+、H+
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
B. 向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色
C. 向一定体积的热浓硫酸中加入足量的铁粉,生成的气体能被烧碱溶液完全吸收
D. 将SO2气体通入溴水,欲检验是否有SO42-生成,可向溶液中滴加Ba(NO3) 2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,改变0.1mol/LRCOOH溶液的pH,溶液中RCOOH、RCOO-的微粒分布分数a(X)= c(X)/[c(RCOOH)+c(RCOO-)];甲酸(HCOOH)与丙酸(CH3CH2COOH)中酸分子的分布分数与pH的关系如图所示。

下列说法正确的是
A. 丙酸的酸性比甲酸强
B. CH3CH2COOH![]() CH3CH2COO-+H+的lgK=-4.88
CH3CH2COO-+H+的lgK=-4.88
C. 若0.1mol/L甲酸溶液的pH=2.33,则0.01mol/L甲酸溶液的pH=3.33
D. 将0.1mol/L的HCOOH溶液与0.1mol/L的HCOONa溶液等体积混合,所得溶液中:c(Na+)>c(HCOOH)>c(HCOO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
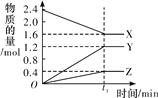
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下表所示:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)单质铜和元素M的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式为________________________________________________________________________。
(2)元素Q、元素Z的含量影响钢铁性能,采用下图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。
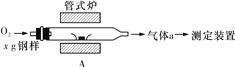
①气体a的成分是________________(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在装置A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是:______________________________________________。
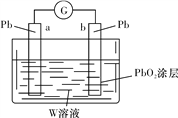
(3)用Z的最高价含氧酸W的溶液作电解质溶液(体积为1 L,假设反应前后溶液体积变化忽略不计)组装成原电池(如图所示)。则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W溶液的浓度由质量分数39%(密度为1.3 g/cm3)变为______mol/L(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论。下列类推结论正确的是
A. SiH4的熔沸点比CH4高,则PH3的熔沸点比NH3高
B. Al(OH)3能溶于NaOH溶液,则Be(OH)2能溶于NaOH溶液
C. 钠在空气中燃烧生成过氧化钠,则锂在空气中燃烧生成过氧化锂
D. F2在暗处遇H2即爆炸,I2在暗处遇H2爆炸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行下列实验:
装置 | 操作 | 现象 |
| 将盛有浓硝酸的烧杯A放入盛有淀粉KI溶液的烧杯C中,然后将铜片放入烧杯A后,立即用烧杯B罩住 | 烧杯A液体上方立即出现大量红棕色气体;一段时间后,红棕色气体消失,烧杯A和C中的液体都变成蓝色 |
下列说法合理的是
A.烧杯A中发生反应:3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
B.红棕色气体消失只与NO2和烧杯C中的KI发生反应有关
C.烧杯C中溶液变蓝只与NO2和C中溶液发生反应有关
D.若将铜片换成铁片,则C中的液体也可能变蓝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com