
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下表所示:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)单质铜和元素M的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式为________________________________________________________________________。
(2)元素Q、元素Z的含量影响钢铁性能,采用下图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。
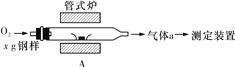
①气体a的成分是________________(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在装置A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是:______________________________________________。
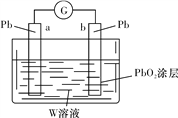
(3)用Z的最高价含氧酸W的溶液作电解质溶液(体积为1 L,假设反应前后溶液体积变化忽略不计)组装成原电池(如图所示)。则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W溶液的浓度由质量分数39%(密度为1.3 g/cm3)变为______mol/L(保留一位小数)。
【答案】 3Cu+8H++2NO===3Cu2++2NO↑+4H2O O2、SO2、CO2 5O2+3FeS![]() 3SO2+Fe3O4 Pb-2e-+SO
3SO2+Fe3O4 Pb-2e-+SO![]() === PbSO4 5.1
=== PbSO4 5.1
【解析】分析:X、Y、Z、M、Q、R是6种短周期元素,图表中数据分析,原子半径大小可知X、Y、Z为同周期元素,且为第三周期元素,结合化合价判断分别为:Mg、Al、S,M、Q为第二周期元素,结合化合价判断分别为:N、C,R为H元素,结合元素周期律、物质的性质和问题分析解答。
详解:根据以上分析可知X、Y、Z、M、Q、R分别为:Mg、Al、S、N、C、H,则
(1)元素M的最高价氧化物对应的水化物的稀溶液是稀硝酸,具有强氧化性,能与铜反应生成硝酸铜、NO和水,则发生反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
(2)①该装置中C、S在A装置中被氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余,所以气体a的成分是SO2、CO2、O2;
②若钢样中S以FeS形式存在,在装置A中反应生成SO2和稳定的黑色氧化物,应该是四氧化三铁,Fe元素化合价由+2价变为+3价,-2价的S被氧化为+4价,结合电子得失守恒可知反应方程式为5O2+3FeS![]() 3SO2+Fe3O4;
3SO2+Fe3O4;
(3)a电极是铅,b电极表面涂有二氧化铅,则a电极是负极,电解质溶液是硫酸,则在a电极上发生的反应可表示为Pb-2e-+SO42-=PbSO4。总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,若电池工作一段时间后,a极消耗0.05 mol Pb,则消耗0.1mol硫酸。反应前硫酸的物质的量是![]() ,所以硫酸溶液的浓度变为(5.2mol-0.1mol)÷1L=5.1mol/L。
,所以硫酸溶液的浓度变为(5.2mol-0.1mol)÷1L=5.1mol/L。


科目:高中化学 来源: 题型:
【题目】为探索生命现象中的有关微观变化,科学家常以 ![]() C标记的化合物为示踪剂,下列关于
C标记的化合物为示踪剂,下列关于 ![]() C的说法中正确的是( )
C的说法中正确的是( )
A.质量数是6
B.质子数是6
C.电子数是14
D.中子数是14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应原理对于生产、生活及环境保护具有重要意义。请回答下列问题:
(1)常温下,物质的量浓度均为0.1 mol·L-1的四种溶液①NH4NO3 ②CH3COONa ③(NH4)2SO4 ④Na2CO3,pH从大到小排列顺序为_________________(填序号)。
(2)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图所示。
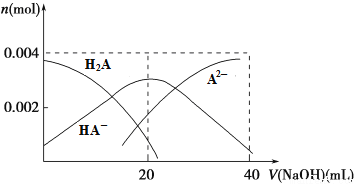
则当v(NaOH)=20 mL时,溶液中离子浓度大小关系:________,水的电离程度比纯水________(填“大”、“小”或“相等”)。
(3)含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为________________________。
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
(4)利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔
和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为_____________________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e- 时,两极的质量差为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 二氧化锰与浓盐酸反应制氯气:MnO2+4HCl(浓)![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B. 向NH4Al(SO4)2溶液中加入过量NaOH溶液:Al3++4OH-=AlO2-+2H2O
C. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=NO3-+NO2-+H2O
D. 用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. 澄清透明的溶液中:Al3+、Cu2+、SO42-、Cl-
B. 中性溶液中:Al3+、NH4+、Cl-、S2-
C. c(OH-)<![]() 的溶液中:Na+、Ca2+、ClO-、NO3-
的溶液中:Na+、Ca2+、ClO-、NO3-
D. 1mo/L的KNO3溶液中:H+、Fe2+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组物质:①![]() C和
C和![]() C;②石墨和足球烯C60;③漂白粉和漂白液的主要成分;④正丁烷和异庚烷;⑤乙烯和聚乙烯;⑥
C;②石墨和足球烯C60;③漂白粉和漂白液的主要成分;④正丁烷和异庚烷;⑤乙烯和聚乙烯;⑥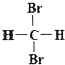 和
和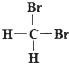 ;⑦丙烷和环丙烷;⑧CH3—CH2—CH2—CH3和CH3—CH(CH3)CH3。请用序号填空:
;⑦丙烷和环丙烷;⑧CH3—CH2—CH2—CH3和CH3—CH(CH3)CH3。请用序号填空:
(1)__________组两者互为同位素。
(2)__________组两者互为同素异形体。
(3)__________组两者属于同系物。
(4)__________组两者互为同分异构体。
(5)__________组两者是同一物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色 | 说明该食盐不是加碘盐 |
B | 银氨溶液中滴入少量组成为C2H4O2的液态有机物,水浴微热,有银镜出现 | 可确定该有机物一定是甲酸甲酯 |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3-=I2+I- |
D | 浓硫酸与乙醇170℃共热,制得的气体通入酸性高锰酸钾溶液,溶液紫色褪去 | 制得的气体产物为乙烯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍.一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团.且B的核磁共振氢谱显示有3组不同的峰.
(1)A的分子式是 .
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等且生成水的量也相等的是(填序号) .
A.C5H12O3
B.C4H10
C.C6H10O4
D.C5H10O
(3)①B的结构简式是 . ②A不能发生的反应是(填序号) .
A.取代反应 B.消去反应 C.酯化反应 D.还原反应
(4)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,该异构体的结构简式是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的红外光谱和核磁共振氢谱图如图所示,下列说法中错误的是( ) 
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.若A的化学式为C2H6O,则其结构简式为CH3﹣O﹣CH3
C.仅由其核磁共振氢谱图无法得知其分子中的氢原子总数
D.由核磁共振氢谱图可知,该有机物分子中有三种不同的氢原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com