
【题目】下列指定反应的离子方程式正确的是
A. 二氧化锰与浓盐酸反应制氯气:MnO2+4HCl(浓)![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B. 向NH4Al(SO4)2溶液中加入过量NaOH溶液:Al3++4OH-=AlO2-+2H2O
C. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=NO3-+NO2-+H2O
D. 用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是

A. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B. 元素W的最高价氧化物对应水化物的酸性比Q的强
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用某种仪器量一液体体积时,平视读数为V1mL,仰视读数为V2mL,俯视读数为V3mL,若V3>V1>V2 , 则所使用仪器可能是( )
A.容量瓶
B.量筒
C.碱式滴定管
D.以上仪器均不可能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 1molCO2含有2mol 氧原子 B. 2molCO2含有2mol 氧原子
C. CO2的摩尔质量是44 D. 1molCO2的质量是44g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学与生产、生活的认识正确的是
A. 绿色食品就是不使用化肥农药,不含任何化学物质的食品
B. 用Ba(OH)2处理含Cu2+的废水,可消除水中重金属离子的污染
C. 煤经过气化和液化等物理变化可转化为清洁燃料
D. ![]() 和CO2生成可降解聚合物
和CO2生成可降解聚合物 ,反应符合绿色化学的原则
,反应符合绿色化学的原则
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子.元素Y的负一价离子的最外层电子数与次外层的相同.回答下列问题:
(1)单质M的晶体类型为 , 晶体中原子间通过作用形成面心立方密堆积,其中M原子的配位数为 .
(2)元素Y基态原子的核外电子排布式为 , 其同周期元素中,第一电离能最大的是(写元素符号).元素Y的含氧酸中,酸性最强的是(写化学式),该酸根离子的立体构型为 .
(3)M与Y形成的一种化合物的立方晶胞如图所示. 
①该化合物的化学式为 , 已知晶胞参数a=0.542nm,此晶体的密度为gcm﹣3 . (写出计算式,不要求计算结果.阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是 . 此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下表所示:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)单质铜和元素M的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式为________________________________________________________________________。
(2)元素Q、元素Z的含量影响钢铁性能,采用下图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。
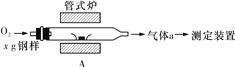
①气体a的成分是________________(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在装置A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是:______________________________________________。
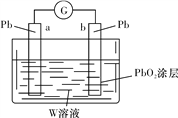
(3)用Z的最高价含氧酸W的溶液作电解质溶液(体积为1 L,假设反应前后溶液体积变化忽略不计)组装成原电池(如图所示)。则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W溶液的浓度由质量分数39%(密度为1.3 g/cm3)变为______mol/L(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.![]()
B.(2b﹣a)mol/L
C.![]()
D.(10b﹣5a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲进行如下实验探究金属与浓硫酸反应。试回答下列问题。
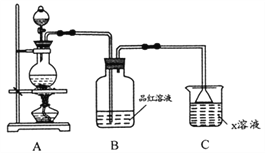
(1)利用上图装置研究铜与浓硫酸反应,反应化学方程式为_________;B装置的目的是______;x溶液为___________。
(2)将上述实验中的铜改为黄铜(铜锌合金),实验后阶段可观察到倒立漏斗边缘有气体冒出,且越来越快。该气体可能为____,气体产生越来越快的原因可能是_____(至少两点)。验证该气体的实验方案如下:
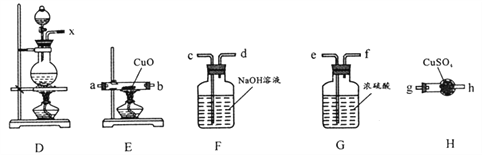
①装置连接顺序:x→_________;
②能证明上述假设成立的实验现象是__________。
(3)取少量镁粉加入盛浓硫酸的烧杯,在通风橱中实验。充分反应后溶液中有灰白色悬浮物,设计方案研究该悬浮物的组成,请帮助完善。(假设镁的化合物都溶于稀酸)
![]() _____
_____
写出产生该灰白色悬浮物主要反应的化学方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com