
【题目】用某种仪器量一液体体积时,平视读数为V1mL,仰视读数为V2mL,俯视读数为V3mL,若V3>V1>V2 , 则所使用仪器可能是( )
A.容量瓶
B.量筒
C.碱式滴定管
D.以上仪器均不可能
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素最高价氧化物对应的水化物之间两两皆能反应。请回答下列问题:
(1)B元素的原子结构示意图是______________;D元素在周期表中的位置是第________周期________族。
(2)A、B、C和F可组成一种化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式:_______________________,_______________________________。
(3)写出E2C3分别与盐酸和氢氧化钠溶液反应的离子方程式:_______________________________ ,_________________________________。
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐相互反应的离子方程式为_____________________________________________________。
(5)A、C、F间可形成甲、乙两种微粒,它们均为-1价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为_______________________________。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为________(填序号)。
①a mol ②b mol ③a/3 mol ④b/3 mol ⑤0 ⑥(4a-b) mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探索生命现象中的有关微观变化,科学家常以 ![]() C标记的化合物为示踪剂,下列关于
C标记的化合物为示踪剂,下列关于 ![]() C的说法中正确的是( )
C的说法中正确的是( )
A.质量数是6
B.质子数是6
C.电子数是14
D.中子数是14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用太阳能分解水制氢,若光解0.02mol水,下列说法正确的是( )
A.可生成H2的质量为0.02g
B.可生成氢的原子数为2.408×1023个
C.可生成H2的体积为0.224L(标准情况)
D.生成H2的量理论上等于0.04mol Na与水反应产生H2的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
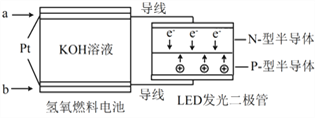
A. a处通入氧气, b处通氢气
B. 通入H2的电极发生反应:H2-2e- = 2H+
C. 通入O2的电极发生反应:O2 + 4e- + 2H2O = 4OH-
D. 该装置将化学能最终转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应原理对于生产、生活及环境保护具有重要意义。请回答下列问题:
(1)常温下,物质的量浓度均为0.1 mol·L-1的四种溶液①NH4NO3 ②CH3COONa ③(NH4)2SO4 ④Na2CO3,pH从大到小排列顺序为_________________(填序号)。
(2)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图所示。
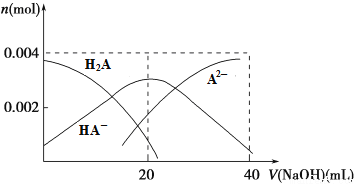
则当v(NaOH)=20 mL时,溶液中离子浓度大小关系:________,水的电离程度比纯水________(填“大”、“小”或“相等”)。
(3)含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为________________________。
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
(4)利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔
和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为_____________________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e- 时,两极的质量差为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 二氧化锰与浓盐酸反应制氯气:MnO2+4HCl(浓)![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B. 向NH4Al(SO4)2溶液中加入过量NaOH溶液:Al3++4OH-=AlO2-+2H2O
C. 用氢氧化钠溶液吸收工业废气中的NO2:2NO2+2OH-=NO3-+NO2-+H2O
D. 用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍.一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团.且B的核磁共振氢谱显示有3组不同的峰.
(1)A的分子式是 .
(2)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量相等且生成水的量也相等的是(填序号) .
A.C5H12O3
B.C4H10
C.C6H10O4
D.C5H10O
(3)①B的结构简式是 . ②A不能发生的反应是(填序号) .
A.取代反应 B.消去反应 C.酯化反应 D.还原反应
(4)A还有另一类酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,该异构体的结构简式是: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com