
ЁОЬтФПЁПMЪЧЕкЫФжмЦкдЊЫиЃЌзюЭтВужЛга1ИіЕчзгЃЌДЮЭтВуЕФЫљгадзгЙьЕРОљГфТњЕчзгЃЎдЊЫиYЕФИКвЛМлРызгЕФзюЭтВуЕчзгЪ§гыДЮЭтВуЕФЯрЭЌЃЎЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЕЅжЪMЕФОЇЬхРраЭЮЊ ЃЌ ОЇЬхжадзгМфЭЈЙ§зїгУаЮГЩУцаФСЂЗНУмЖбЛ§ЃЌЦфжаMдзгЕФХфЮЛЪ§ЮЊ ЃЎ
ЃЈ2ЃЉдЊЫиYЛљЬЌдзгЕФКЫЭтЕчзгХХВМЪНЮЊ ЃЌ ЦфЭЌжмЦкдЊЫижаЃЌЕквЛЕчРыФмзюДѓЕФЪЧЃЈаДдЊЫиЗћКХЃЉЃЎдЊЫиYЕФКЌбѕЫсжаЃЌЫсадзюЧПЕФЪЧЃЈаДЛЏбЇЪНЃЉЃЌИУЫсИљРызгЕФСЂЬхЙЙаЭЮЊ ЃЎ
ЃЈ3ЃЉMгыYаЮГЩЕФвЛжжЛЏКЯЮяЕФСЂЗНОЇАћШчЭМЫљЪОЃЎ 
ЂйИУЛЏКЯЮяЕФЛЏбЇЪНЮЊ ЃЌ вбжЊОЇАћВЮЪ§a=0.542nmЃЌДЫОЇЬхЕФУмЖШЮЊgcmЉ3 ЃЎ ЃЈаДГіМЦЫуЪНЃЌВЛвЊЧѓМЦЫуНсЙћЃЎАЂЗќМгЕТТоГЃЪ§ЮЊNAЃЉ
ЂкИУЛЏКЯЮяФбШмгкЫЎЕЋвзШмгкАБЫЎЃЌЦфдвђЪЧ ЃЎ ДЫЛЏКЯЮяЕФАБЫЎШмвКгіЕНПеЦјдђБЛбѕЛЏЮЊЩюРЖЩЋЃЌЩюРЖЩЋШмвКжабєРызгЕФЛЏбЇЪНЮЊ ЃЎ
ЁОД№АИЁП
ЃЈ1ЃЉН№ЪєОЇЬхЃЛН№ЪєМќЃЛ12
ЃЈ2ЃЉ1s22s22p63s23p5ЃЛArЃЛHClO4ЃЛе§ЫФУцЬх
ЃЈ3ЃЉCuClЃЛ![]() ?ЃЛ?Cu+ПЩгыАБаЮГЩвзШмгкЫЎЕФХфЮЛЛЏКЯЮяЃЛ[CuЃЈNH3ЃЉ4]2+
?ЃЛ?Cu+ПЩгыАБаЮГЩвзШмгкЫЎЕФХфЮЛЛЏКЯЮяЃЛ[CuЃЈNH3ЃЉ4]2+
ЁОНтЮіЁПНтЃКЃЈ1.ЃЉЭЪєгкН№ЪєЃЌН№ЪєбєРызггыЕчзгжЎМфЭЈЙ§Н№ЪєМќНсКЯдквЛЦ№ЃЌОЇЬхРраЭЮЊН№ЪєОЇЬхЃЌЭОЇЬхЪЧУцаФСЂЗНЖбЛ§ЃЌВЩгУбиXЁЂYЁЂZШ§жсЧаИюЕФЗНЗЈжЊЃЌУПИіЦНУцЩЯЭдзгЕФХфЮЛЪ§ЪЧ4ЃЌШ§ИіУцЙВга4ЁС3=12ИіЭдзгЃЌЫљвдУПИіЭдзгЕФХфЮЛЪ§ЪЧ12ЃЛЫљвдД№АИЪЧЃКН№ЪєОЇЬхЃЛН№ЪєМќЃЛ12ЃЛ
ЃЈ2.ЃЉдЊЫиТШЪЧ17КХдЊЫиЃЌЮЛгкЕкШ§жмЦкЃЌвРОнЙЙдьдРэЦфЛљЬЌЕчзгХХВМЮЊЃК1s22s22p63s23p5ЃЛЦфЭЌжмЦкдЊЫижаЃЌЕквЛЕчРыФмзюДѓЕФЪЧArЃЌКЌТШЕФЫсжаИпТШЫсЫсадзюЧПЪЧКЌбѕЫсжазюЧПЫсЃЌЛЏбЇЪНЮЊЃКHClO4 ЃЌ ИпТШЫсЫсИљРызгжаТШдзгЮЊsP3дгЛЏЃЌУЛгаЙТЖдЕчзгЪ§ЃЌСЂЬхЙЙаЭЮЊе§ЫФУцЬхЃЛЫљвдД№АИЪЧЃК1s22s22p63s23p5ЃЛArЃЛ HClO4ЃЛ е§ЫФУцЬхЃЛ
ЃЈ3.ЃЉЂйвРОнОЇАћНсЙЙЃЌРћгУЧаИюЗЈЗжЮіЃЌУПИіОЇАћжаКЌгаЭдзгИіЪ§ЮЊЃК8ЁС ![]() +6ЁС
+6ЁС ![]() =4ЃЌТШдзгИіЪ§ЮЊ4ЃЌдђЛЏбЇЪНЮЊЃЛCuClЃЛ1molОЇАћжаКЌга4molCuClЃЌ1molОЇАћЕФжЪСПЮЊMЃЈCuClЃЉЁС4ЃЌОЇАћВЮЪ§a=0.542nmЃЌдђОЇЬхУмЖШЮЊЃЛ
=4ЃЌТШдзгИіЪ§ЮЊ4ЃЌдђЛЏбЇЪНЮЊЃЛCuClЃЛ1molОЇАћжаКЌга4molCuClЃЌ1molОЇАћЕФжЪСПЮЊMЃЈCuClЃЉЁС4ЃЌОЇАћВЮЪ§a=0.542nmЃЌдђОЇЬхУмЖШЮЊЃЛ ![]() ЃЛЫљвдД№АИЪЧЃКCuClЃЛ
ЃЛЫљвдД№АИЪЧЃКCuClЃЛ ![]() ЃЛ
ЃЛ
ЂкCu+ПЩгыАБаЮГЩвзШмгкЫЎЕФХфЮЛЛЏКЯЮяЃЌЫљвдCuClФбШмгкЫЎЕЋвзШмгкАБЫЎЃЛИУЛЏКЯЮяжаCu+БЛбѕЛЏЮЊCu2+ ЃЌ ЫљвдЩюРЖЩЋШмвКжабєРызгЮЊЃК[CuЃЈNH3ЃЉ4]2+ЃЛЫљвдД№АИЪЧЃКCu+ПЩгыАБаЮГЩвзШмгкЫЎЕФХфЮЛЛЏКЯЮяЃЈЛђХфРызгЃЉЃЛ[CuЃЈNH3ЃЉ4]2+ ЃЎ


 жаПМРћНЃжаПМЪдОэЛуБрЯЕСаД№АИ
жаПМРћНЃжаПМЪдОэЛуБрЯЕСаД№АИ НЬг§ЪРМвзДдЊОэЯЕСаД№АИ
НЬг§ЪРМвзДдЊОэЯЕСаД№АИ ЛЦИдПЮЬУзївЕБОЯЕСаД№АИ
ЛЦИдПЮЬУзївЕБОЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЛьКЯЮяПЩвдгУЗжвКЗЈЗжРыЕФЪЧ( )
A.ЪГбЮЫЎжаЕФФрЩГB.ЕтгыЫФТШЛЏЬМC.жВЮягЭгыЫЎD.ЬМЫсБЕгыТШЛЏвј
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПLEDВњЦЗЕФЪЙгУЮЊГЧЪадіЬэЩЋВЪЁЃЯТЭМЪЧЧтбѕШМСЯЕчГиЧ§ЖЏLEDЗЂЙтЕФвЛжжзАжУЪОвтЭМЁЃЯТСагаЙиа№Ъіе§ШЗЕФЪЧ
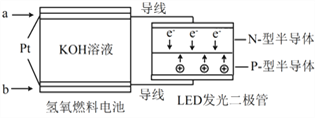
A. aДІЭЈШыбѕЦјЃЌ bДІЭЈЧтЦј
B. ЭЈШыH2ЕФЕчМЋЗЂЩњЗДгІЃКH2Ѓ2e- ЃН 2H+
C. ЭЈШыO2ЕФЕчМЋЗЂЩњЗДгІЃКO2 + 4e- + 2H2O ЃН 4OHЃ
D. ИУзАжУНЋЛЏбЇФмзюжезЊЛЏЮЊЕчФм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПРћгУЯТЭМзАжУВтЖЈжаКЭШШЕФЪЕбщВНжшШчЯТЃК
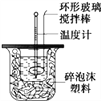
ЂйгУСПЭВСПШЁ50 mL 0.25 molЁЄLЃ1СђЫсЕЙШыаЁЩеБжаЃЌВтГіСђЫсЮТЖШЃЛ
ЂкгУСэвЛСПЭВСПШЁ50 mL 0.55 molЁЄLЃ1NaOHШмвКЃЌВЂгУСэвЛЮТЖШМЦВтГіЦфЮТЖШЃЛ
ЂлНЋNaOHШмвКЕЙШыаЁЩеБжаЃЌЩшЗЈЪЙжЎЛьКЯОљдШЃЌВтГіЛьКЯвКзюИпЮТЖШЁЃ
ЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЕЙШыNaOHШмвКЕФе§ШЗВйзїЪЧ__________ЁЃ
A.биВЃСЇАєЛКТ§ЕЙШы BЃЎЗжШ§ДЮЩйСПЕЙШы CЃЎвЛДЮбИЫйЕЙШы
ЃЈ2ЃЉЪЙСђЫсгыNaOHШмвКЛьКЯОљдШЕФе§ШЗВйзїЪЧ________ЁЃ
A.гУЮТЖШМЦаЁаФНСАш BЃЎНвПЊгВжНЦЌгУВЃСЇАєНСАш
CЃЎЧсЧсЕиеёЕДЩеБ DЃЎгУЬздкЮТЖШМЦЩЯЕФЛЗаЮВЃСЇНСАшАєЧсЧсЕиНСЖЏ
ЃЈ3ЃЉЪЕбщЪ§ОнШчЯТБэЃК
ЂйЧыЬюаДЯТБэжаЕФПеАзЃК________ЁЃ
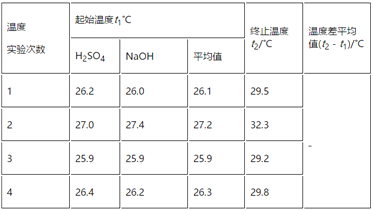
ЂкНќЫЦШЯЮЊ0.55 molЁЄLЃ1NaOHШмвККЭ0.25 molЁЄLЃ1СђЫсШмвКЕФУмЖШЖМЪЧ1 gЁЄcmЃ3ЃЌжаКЭКѓЩњГЩШмвКЕФБШШШШнcЃН4.18 JЁЄgЃ1ЁЄЁцЃ1ЁЃвРОнЩЯБэЪ§ОнМЦЫужаКЭШШІЄHЃН________(ШЁаЁЪ§ЕуКѓвЛЮЛ)ЁЃ
ЂлжаКЭШШВтЖЈЪЕбщжаЃЌЯТСаВйзївЛЖЈЛсНЕЕЭЪЕбщзМШЗадЕФЪЧЃЈ______ЃЉЁЃ
A.гУЕЮЖЈЙмЃЈОЋСПвЧЦїЃЌЖСЪ§БЃСєЕН0.01ЃЉШЁЫљгУЫсМюШмвКЕФЬхЛ§
B.NaOHШмвКдкЕЙШыаЁЩеБЪБЃЌгаЩйСПНІГі
C.ДѓЁЂаЁЩеБЬхЛ§ЯрВюНЯДѓЃЌМаВуМфЗХЕФЫщХнФЫмСЯНЯЖр
D.ВтСПСђЫсШмвКЕФЮТЖШМЦгУЫЎЯДОЛКѓВХгУРДВтNaOHШмвКЕФЮТЖШ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСажИЖЈЗДгІЕФРызгЗНГЬЪНе§ШЗЕФЪЧ
A. ЖўбѕЛЏУЬгыХЈбЮЫсЗДгІжЦТШЦјЃКMnO2+4HCl(ХЈ)![]() Mn2++2Cl-+Cl2Ёќ+2H2O
Mn2++2Cl-+Cl2Ёќ+2H2O
B. ЯђNH4Al(SO4)2ШмвКжаМгШыЙ§СПNaOHШмвКЃКAl3++4OH-=AlO2-+2H2O
C. гУЧтбѕЛЏФЦШмвКЮќЪеЙЄвЕЗЯЦјжаЕФNO2ЃК2NO2+2OH-=NO3-+NO2-+H2O
D. гУЖшадЕчМЋЕчНтMgCl2ШмвКЃК2Cl-+2H2O![]() Cl2Ёќ+H2Ёќ+2OH-
Cl2Ёќ+H2Ёќ+2OH-
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаФПЕФФмДяЕНЕФЪЧЃЈ ЃЉ
A.НЋ58.5 g NaClШмгк1 LЫЎжаЃЌПЩЕУ1 mol/LЕФNaClШмвК
B.ПЩЪЙгУ250 mLШнСПЦПЗжСНДЮЭъГЩ490 mLФГХЈЖШЕФBaCl2ШмвКЕФХфжЦ
C.НЋ25.0 gЕЈЗЏШмгкЫЎКѓХфГЩ100 mLШмвКЫљЕУШмвКХЈЖШЮЊ1 mol/L
D.НЋ78 g Na2O2ШмгкЫЎХфГЩ1 LШмвКЃЌПЩЕУЕНХЈЖШЮЊ1 mol/LЕФШмвК
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЯТСаИїзщЮяжЪЃКЂй![]() CКЭ
CКЭ![]() CЃЛЂкЪЏФЋКЭзуЧђЯЉC60ЃЛЂлЦЏАзЗлКЭЦЏАзвКЕФжївЊГЩЗжЃЛЂме§ЖЁЭщКЭвьИ§ЭщЃЛЂнввЯЉКЭОлввЯЉЃЛЂо
CЃЛЂкЪЏФЋКЭзуЧђЯЉC60ЃЛЂлЦЏАзЗлКЭЦЏАзвКЕФжївЊГЩЗжЃЛЂме§ЖЁЭщКЭвьИ§ЭщЃЛЂнввЯЉКЭОлввЯЉЃЛЂо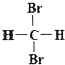 КЭ
КЭ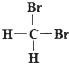 ЃЛЂпБћЭщКЭЛЗБћЭщЃЛЂрCH3ЁЊCH2ЁЊCH2ЁЊCH3КЭCH3ЁЊCH(CH3)CH3ЁЃЧыгУађКХЬюПеЃК
ЃЛЂпБћЭщКЭЛЗБћЭщЃЛЂрCH3ЁЊCH2ЁЊCH2ЁЊCH3КЭCH3ЁЊCH(CH3)CH3ЁЃЧыгУађКХЬюПеЃК
(1)__________зщСНепЛЅЮЊЭЌЮЛЫиЁЃ
(2)__________зщСНепЛЅЮЊЭЌЫивьаЮЬхЁЃ
(3)__________зщСНепЪєгкЭЌЯЕЮяЁЃ
(4)__________зщСНепЛЅЮЊЭЌЗжвьЙЙЬхЁЃ
(5)__________зщСНепЪЧЭЌвЛЮяжЪЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЬМКЭЕЊЕФЛЏКЯЮядкЩњВњЩњЛюжаЙуЗКДцдкЁЃЛиД№ЯТСаЮЪЬт:
(1)Ш§ТШЛЏЕЊ(NCl3)ЪЧвЛжжЛЦЩЋЁЂгЭзДЁЂОпгаДЬМЄадЦјЮЖЕФЛгЗЂадгаЖОвКЬхЃЌЦфдзгОљТњзу8e-НсЙЙЁЃаДГіЦфЕчзгЪН_____________________ЁЃТШМюЙЄвЕЩњВњЪБЃЌгЩгкЪГбЮЫЎжаЭЈГЃКЌгаЩйСПNH4ClЃЌЖјдквѕМЋЧјгыЩњГЩЕФТШЦјЗДгІВњЩњЩйСПШ§ТШЛЏЕЊЃЌИУЗДгІЕФЛЏбЇСІГЬЪНЮЊ______________ЁЃ
(2)вЛЖЈЬѕМўЯТЃЌВЛЭЌЮяжЪЕФСПЕФCO2гыВЛЭЌЬхЛ§ЕФ1.0mol/LNaOHШмвКГфЗжЗДгІЗХГіЕФШШСПШчЯТБэЫљЪО:
ЗДгІађКХ | CO2ЕФЮяжЪЕФСП/mol | NaOHШмвКЕФЬхЛ§/L | ЗХГіЕФШШСП/kJ |
1 | 0.5 | 0.75 | a |
2 | 1.0 | 2.00 | b |
ИУЬѕМўЯТCO2гыNaOHШмвКЗДгІЩњГЩNaHCO3ЕФШШЛЏбЇЗДгІЗНГЬЪНЮЊ:____________ЁЃ
(3)РћгУCOПЩвдНЋNOзЊЛЏЮЊЮоКІЕФN2ЃЌЦфЗДгІЮЊЃК2NO(g)+2CO(g)![]() N2(g)+2CO2(g)ЃЌЯђШнЛ§ОљЮЊILЕФМзЁЂввЁЂБћШ§ИіКуЮТ(ЗДгІЮТЖШЗжБ№ЮЊ300ЁцЁЂTЁцЁЂ300Ёц)ШнЦїжаЗжБ№МгШыЯрЭЌСПNOКЭCOЃЌВтЕУИїШнЦїжаn(CO)ЫцЗДгІЪБМфtЕФБфЛЏЧщПіШчЯТБэЫљЪО:
N2(g)+2CO2(g)ЃЌЯђШнЛ§ОљЮЊILЕФМзЁЂввЁЂБћШ§ИіКуЮТ(ЗДгІЮТЖШЗжБ№ЮЊ300ЁцЁЂTЁцЁЂ300Ёц)ШнЦїжаЗжБ№МгШыЯрЭЌСПNOКЭCOЃЌВтЕУИїШнЦїжаn(CO)ЫцЗДгІЪБМфtЕФБфЛЏЧщПіШчЯТБэЫљЪО:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(МзШнЦї)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(CO)(ввШнЦї)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(CO)(БћШнЦї)/mol | 1.00 | 0.65 | 0.53 | 0.45 |
ЂйМзШнЦїжаЃЌ0ЁЋ40minФкгУNOЕФХЈЖШБфЛЏБэЪОЕФЦНОљЗДгІЫйТЪv(NO)=_______ЁЃ
ЂкИУЗДгІЕФЁїH______0(ЬюЁА>ЁБЛђЁА<ЁБ)ЁЃ
ЂлБћШнЦїДяЕНЦНКтЪБЃЌCOЕФзЊЛЏТЪЮЊ____________________________ЁЃ
(4)ГЃЮТЯТЃЌдк(NH4)2C2O4ШмвКжаЃЌЗДгІNH4++C2O42-+H2O![]() NH3ЁЄ2H2O+HC2O4-ЕФЦНКтГЃЪ§K=___ЁЃ(вбжЊГЃЮТЯТЃЌNH3ЁЄH2OЕФЕчРыЦНКтГЃЪ§KbЁж2ЁС10-5ЃЌH2C2O4ЕФЕчРыЦНКтГЃЪ§Ka1Ёж5ЁС10-2ЃЌKa2Ёж5ЁС10-5)
NH3ЁЄ2H2O+HC2O4-ЕФЦНКтГЃЪ§K=___ЁЃ(вбжЊГЃЮТЯТЃЌNH3ЁЄH2OЕФЕчРыЦНКтГЃЪ§KbЁж2ЁС10-5ЃЌH2C2O4ЕФЕчРыЦНКтГЃЪ§Ka1Ёж5ЁС10-2ЃЌKa2Ёж5ЁС10-5)
(5)ШчЭМЪЧдкЫсадЕчНтжЪШмвКжаЃЌвдЧщадВФСЯзїЕчМЋЃЌНЋCO2зЊЛЏЮЊБћЯЉЕФдРэФЃаЭЁЃ
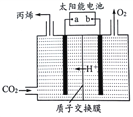
ЂйЬЋбєФмЕчГиЕФИКМЋЪЧ_________ЁЃ(ЬюЁАaЁБЛђЁАbЁБ)
ЂкЩњГЩБћЯЉЕФЕчМЋЗДгІЪНЪЧ____________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙибцЩЋЗДгІЕФБэЪіШЗЧаЕФЪЧ(ЁЁЁЁ)
A. бцЩЋЗДгІЪЧдЊЫиЕФЬигааджЪ
B. бцЩЋЗДгІЪЧЕЅжЪЕФЬигааджЪ
C. бцЩЋЗДгІЪЧРызгЕФЬигааджЪ
D. бцЩЋЗДгІЪЧЛЏКЯЮяЕФЬигааджЪ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com